Das Wichtigste verständlich
| Multiples Myelom (MM, Plasmozytom, Kahlersche Krankheit) bedeutet wörtlich „viele (multiple) Knochenmarksgeschwulste“. Es ist eine bösartige (maligne) Erkrankung mit unkontrollierter Vermehrung von Plasmazellen, einem erhöhten Risiko für einen Knochenbruch („pathologische Fraktur“), einer Abnahme der Nierenleistung (Niereninsuffizienz) und einer Bluteindickung. Es ist eine bösartige Erkrankung bestimmter Zellen des Immunsystems: man findet im Knochenmark eine unkontrollierte Vermehrung von Plasmazellen. Die Erkrankung gehört zu den niedrig malignen Non-Hodgkin-Lymphomen.
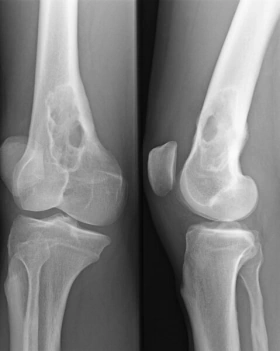
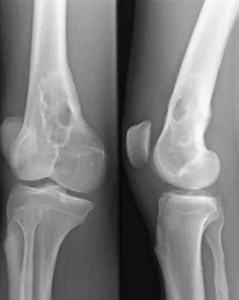
Symptome: Die Vermehrung der Myelomzellen im Knochen verdrängt das normale Knochenmark, so dass eine Blutarmut und eine Abwehrschwäche des Immunsystems auftritt. Der Knochen wird an den Stellen der Zellwucherungen dünner (umschriebene Knochenauflösungen, Osteolysen), und es können Spontanfrakturen (Knochenbrüche „aus heiterem Himmel“) auftreten. Das unkontrolliert vermehrt gebildete Eiweiß der Myelomzellen verstopft die Nieren, es kommt zum Nierenversagen (Niereninsuffizienz bei „Plasmozytomniere“) und das Blut wird dickflüssiger; es entsteht ein Hyperviskositätssyndrom (Blutverdickung mit Verschlechterung der Fließeigenschaften). Dies führt zu Durchblutungsstörungen, die im Gehirn zu neurologischen Ausfällen führen können. 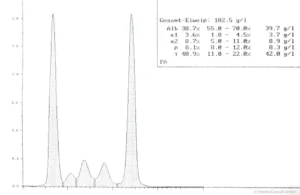 Diagnostik: Die Erkrankung wird durch Laborbefunde diagnostiziert. Charakteristisch ist das Bild der Immunglobulinverteilung in der Serumelektrophorese (typisch der schmalbasige hohe Peak der Gamma-Globuline) und eine Ausscheidung kleiner Eiweiße des Immunsystems („freie Leichtketten“) im Urin. Wenn ein multiples Myelom diagnostiziert wird, muss eine Untersuchung der Knochen auf bruchgefährdete Stellen (Knochenauflösungen, Osteolysen) erfolgen. Therapie: In frühen Stadien wird wegen des meist langsamen Fortschreitens (geringe Progredienz) oft nur beobachtend zugewartet. Bei fortschreitender Erkrankung wird eine Chemotherapie eingeleitet. In geeigneten Fällen kommt eine Knochenmarkstransplantation in Betracht. Heute lässt die Entwicklung moderner Medikamente (z. B. von Proteasominhibitoren und spezifischer Antikörper, s. u.) auf eine weitere Verbesserung der Prognose hoffen. |
Entstehung
Es wird angenommen, dass sich das multiple Myelom entweder spontan oder aus der Vorstufe einer benignen Gammopathie entwickelt.
Im zweiten Fall beginnt die Erkrankung mit einer noch stationär erscheinenden und als benigne eingestuften monoklonalen Gammopathie, aus der sich innerhalb von Monaten bis vielen Jahren eine erkennbar fortschreitende Erkrankung entwickelt.
Die benigne monoklonale Gammopathie ist durch einen schmalbasigen Peak in der Eiweißelektrophorese (Paraproteine) ohne sonstige Symptomatik und bei noch fehlender Knochenmarksinfiltration mit Plasmazellen gekennzeichnet. Paraproteine sind im Gegensatz zu den normalen Immunglobulinen immunologisch nicht aktiv.
MGUS, genetische Grundlage: Da die weitere Entwicklung der sog. benignen Gammopathie, bei der in bis zu 3% ein multiples Myelom oder ein Morbus Waldenström entsteht, nicht absehbar ist, wird in diesem Stadium heute oft der Begriff „monoklonale Gammopathie unklarer Signifikanz“ (MGUS) gewählt. Zugrunde liegt ein genetisch abnormer Plasmazellklon; in einigen Fällen wurde eine Mutation des MyD88-Gens (Gen des „Myeloid differentiation protein 88“) in B-Zellen des Knochenmarks nachgewiesen. MyD88 spielt eine Rolle bei der entzündungsassoziierten Krebsentstehung 1. Aus MGUS kann das „schwelende multiple Myelom“ (smoldering multiple myeloma, SMM) und schließlich das multiple Myelom entstehen. In den Zellen des multiplen Myeloms sind meist Veränderungen auf Chromosom 4 und 14 nachweisbar. Die genetische Grundlage des multiplen Myeloms stellt sich inzwischen als sehr komplex heraus. Eine Microarray-Analyse ergab 5124 unterschiedlich exprimierte Gene (DEGs): 2696 von ihnen waren hochreguliert, 2428 Gene im Vergleich zu den normalen Kontrollen herunterreguliert. RAD54L wurde als potenzielles therapeutisches Ziel identifiziert.2
Wie maligne Zellen der Immunüberwachung entkommen: Zellen des multiplen Myeloms entgehen der Immunüberwachung durch verschiedene Mechanismen; diese Mechanismen bewirken beispielsweise eine Expansion regulatorischer T-Lymphozyten (Treg) und eine Verminderung der zytotoxischen-T-Zell- und B-Zell-Funktion und verschaffen sich so Vorteile für ihre ungehinderte Vermehrung. Die Beeinflussung der immunologischen Reaktionsfähigkeit könnte daher ein wirkungsvoller therapeutischer Angriffspunks beim multiplen Myelom sein 3.
Paraproteine:
Ein Teil der Patienten mit multiplem Myelom bildet lediglich Bence-Jones-Proteine, die im Urin nachweisbar sind (s.u.), etwa 55 % bilden IgG Paraproteine (IgG-Plasmozytom), etwa 20 % IgA-Paraproteine (IgA-Plasmozytom).
Etwa 20% der Patienten mit multiplem Myelom entwickeln eine Amyloidose, vorzugsweise die mit Bence-Jones-Proteinurie.
Mikro-RNA: Neue Erkenntnisse besagen, dass Mikro-RNA (miRNA) eine auslösende Rolle spielen können. Sie regulieren die Expression von Genen. Aberrante miRNA können zu ungebemster Proliferation verschiedener Zelltypen und so zu Tumoren und auch zum multiplen Myelom führen. 4
Inzidenz
Das Plasmozytom tritt relativ selten auf; es macht etwa 1% der Krebskrankheiten aus; es häuft sich mit dem Alter. Kinder sind noch nicht betroffen. Die Neuerkrankungen pro Jahr liegen bei 5/100000.
Bei Menschen afrikanische Abstammung ist die Inzidenz doppelt so hoch wie bei Kaukasiern.
Symptomatik
Die Symptomatik des multiplen Myeloms hängt von seinem Entwicklungsstadium ab. In den Anfangsstadien, die meist zufällig durch eine Vermehrung der Plasmaproteine und eine schmalbasige Zacke in der Eiweißelektrophorese auffällt, liegt oft noch keine klinische Symptomatik vor.
Später kommt es in unterschiedlicher Zusammenstellung und Ausprägung zu
- Anämie, Granulozytopenie und Thrombozytopenie mit Leistungsschwäche, Infektionsneigung und Blutungsneigung
- Symptome einer schweren Niereninsuffizienz (Urämie) bei Entwicklung einer Plasmozytomniere (Verstopfung der Tubuli durch Proteinzylinder), die zur raschen Dialysepflichtigkeit führen kann,
- Spontanfrakturen bei lokalen Osteolysen (die oft szintigraphisch nicht nachweisbar sind),
- Symptome einer Hyperkalzämie, wie Herzrhythmusstörungen, Obstipation oder Subileus bei Motilitätsstörung des Darms mit Übelkeit und Störungen der Hirnfunktionen (Enzephalopathie),
- neurologischen und psychiatrischen Störungen, wie Schwindel, Benommenheit, Nystagmus, Sehstörungen, Tinnitus und Hörstörungen, Kopfschmerzen und Krampfanfällen. Diese Symptome sind in ihrer Variabilität und Ausprägung durch Durchblutungsstörungen im Kapillargebiet des Gehirns bei Hyperviskosität des Bluts erklärbar.
Diagnostik
Häufig ist eine unspezifische Allgemeinsymptomatik mit Leistungsschwäche und vermehrter Müdigkeit erster Anlass zu einer Check-up-Untersuchung, bei der sich eine Proteinurie, eine Niereninsuffizienz, eine Hyperkalzämie und/oder ein erhöhter Eiweißgehalt im Blut und in der Elektrophorese ein schmaler Gamma-Gradient ergeben kann.
Die weiteren Untersuchungen beinhalten:
- Suche nach Bence-Jones-Proteinen im Urin: diese sind Leichtketten im Urin, die bei der unkoordinierten Gammaglobulin-Synthese der atypischen Plasmazellen vermehrt ins Blut und in den Urin (Ausscheidung über 1,0 g/24h) gelangen. Ihr Nachweis untermauert die Diagnose.
- Immunelektrophorese, Immunfixation: Nachweis von Paraproteinen (IgG über 3,5 g/dl, IgA über 2,0 g/dl).
- Knochenmarkpunktion: Suche nach einer klonartigen Plasmazellvermehrung,
- Röntgenuntersuchung des Skeletts (Pariser Schema) auf Osteolysen (Herde von Knochenauflösungen): Schädelkalotte, Wirbelsäule, lange Röhrenknochen.
„Liquid Biopsy“
Die MM-Diagnostik stützt sich zunehmend auf periphere Blutproben, aus denen zirkulierende Tumorzellen und Tumor-DNA und -RNA sowie extrazelluläre Vesikel aus Tumorzellen bestimmt werden. Sie erlaubt eine genaue Differenzierung des Tumortyps und lässt auch Sonderformen, wie eine nicht-sekretorische MM, erkennen. Sie erweisen sich als frühe Krankheits- und Prognosemarker. Eine liquid biopsy macht oft eine Knochenmarkbiopsie überflüssig. 5 6 Der Nachweis bestimmter miRNA lässt sich als Marker für spezielle Komplikationen verwenden; so waren miR-103a-3p, miR-449c-5p und let-7a-5p bei einer MM-Niereninsuffizienz stark erhöht gefunden worden. 7
→ Dazu siehe hier.
Staging
Das Staging-System wird ständig überarbeitet. Es enthält Daten der Serum-Biomarker β2-Mikroglobulin, Albumin und Laktatdehydrogenase sowie genomische Merkmale der malignen Plasmazellen, die bei der Fluoreszenz-in-situ-Hybridisierung zu finden sind: t(4;14), del(17p) und t(14). ;16). Mit dem Staging-Ergebnis kann das progressionsfreie Überlebens und das Gesamtüberleben geschätzt werden. 8
Therapie und Verlauf
Das multiple Myelom entwickelt sich meist langsam; bei Vorliegen von Osteolysen (durch lokale Knochenmetastasen) und von Symptomen (s. o.) ist ohne Therapie mit einem Überleben von nur um die 6 Monaten zu rechnen.
Bisherige Therapie: Eine Chemotherapie beinhaltete i. d. R. Melphalan und Glukokortikoide (z. B. Prednisolon). Sie kann das Überleben um einige Monate (bis Jahre) verlängern. Eine Hochdosis-Chemotherapie mit anschließender autologer Stammzelltransplantation ist relativ erfolgreich. Sie kann zu länger anhaltender oder dauerhafter Heilung führen. Der Erfolg ist jedoch wegen der relativ häufigen Graft-versus-Host-Reaktion (Angriff der transplantierten Immunzellen gegen den Körper) eingeschränkt; auch kann ein Relaps auftreten. Inzwischen sind neue medikamentöse Therapieoptionen hinzugekommen, die effektiver wirken.
Standardtherapie und Prognose
Die in erster Linie in Frage kommende Behandlung bei einer Erstfeststellung besteht laut einem Vorschlag für eine Standardtherapie aus einer Kombination eines Proteasom-Inhibitors (z. B. Injektionen von Bortezomib) mit einem oralen Immunmodulator (z. B. Lenalidomid) und einem Kortikosteroid (z. B. Dexamethason). Das mittlere progressionsfreie Überleben liegt darunter bei 41 Monaten (vs. 8,5 Monate ohne Therapie). Bei geeigneten Patienten kann diese Induktionstherapie von einer autologen hämatopoetischen Stammzelltransplantation gefolgt werden. Die Erhaltungstherapie danach beinhaltet nach diesem Schema Lenalidomid. 9
Therapieoptionen: Immunmodulatorische Medikamente (wie Pomalidomid), Proteasom-Inhibitoren (PIs; Carfilzomib und Ixazomib), monoklonale Antikörpern (Elotuzumab, Daratumumab und Isatuximab) und weitere neue Entwicklungen (z. B. mit Panobinostat) erweitern die Optionen bei einer individuellen Therapieentscheidung. 10
Neue Entwicklungen: Mikro-RNA (miRNA) werden ins Zentrum der Überlegungen (s. o.) gestellt. Da eine vermehrte Produktion spezieller solcher miRNA mit der Entwicklung des multiplen Myeloms assoziiert ist, bieten sie sich Marker und auch als Ziel einer Therapie an. 4
Bei Patienten mit dreifach refraktärer Erkrankung werden Therapien, die Pomalidomid, Elotuzumab, PIs der nächsten Generation, Panobinostat oder Selinexor enthalten, als wirksame Behandlungsoptionen dargestellt. 11
Medikamente
Folgende Entwicklungen werden als aussichtsreich angesehen:
- Bortezomib ist ein Proteasom-Hemmer, der beim therapierefraktären multiplen Myelom zu einem erhöhten Ansprechen geführt hat Fu W et al. 12.
- Carfilzomib ist ein Proteasom-Inhibitor der nächsten Generation. Mit ihm ließ sich in Studien ebenfalls eine deutlich Lebensverlängerung erwirken 13 14 15.
- Lenalidomid (Revlimid®) ist ein Nachfolgepräparat des Thalidomid und bewirkt zusammen mit Dexamethason zu einer erhöhten Ansprechrate und einer Erhöhung des progressionsfreien Überlebens um einige Monate.
- Pomalidomid (Pomalyst®) ist ebenfalls ein Nachfolgepräparat des Thalidomid, das jedoch stärker wirkt und weniger Nebenwirkungen hat. Es soll erst dann eingesetzt werden, wenn andere Therapieformen versagt haben.
- Elotuzumab ist ein monoklonaler Antikörper gegen das Oberflächenglykoprotein CS1, das von Myelomzellen in hohem Maße exprimiert wird. Zusammen mit Bortezomib zeigt er erfolgversprechende Ansprechraten 16.
- Vorinostat ist ein Histon-Deacetylase-Inhibitor mit antiproliferativen und Apoptose-fördernden Eigenschaften. Zusammen mit Bortezomib führt er bei Patienten mit therapierefraktärem multiplem Myelom und Therapieversagen auch mit Bortezomib alleine zu einem Ansprechen bei 5 von 6 Patienten 17.
- Ibrutinib (Imbruvica™) ist ein Inhibitor von Brutons Tyrosinekinase zur Behandlung bösartiger B-Zell-Erkrankungen wie der chronisch lymphatischen Leukämie (CLL), dem Mantelzell-Lymphom, dem multiplen Myelom und der Makroglobulinämie Waldenström 18. Brutons Tyrosinekinase wird im multiplen Myelom überexprimiert und scheint ein wirkungsvoller Angriffspunkt für die Therapie mit Ibrutinib zu sein, was nun Studien untermauern sollen 19.
- Daratumumab ist ein humanisierter monoklonaler Antikörper gegen CD38, welches auf Myelomzellen überexprimiert wird. Eine Phase-1-2-Studie weist nach, dass Patienten mit multiplen Vortherapien, inklusive solcher mit einer erfolglosen Knochenmarktransplantation, auf Daratumumab (16 mg/kg KG) in 36 % ansprachen. Das mittlere progressionsfreie Überleben lag bei 5,6 Monaten. Unter denen mit positiver Reaktion hatten 65 % auch nach 12 Monaten keine Progression 20. Laut einer Studie erhöht es gegenüber der derzeitigen Standardtherapie die Ansprechrate (91 % vs. 74 %) und verbessert das progressionsfreie Überleben über 18 Monate (72% vs. 51%). Die Nebenwirkungsrate war ähnlich, die Rate schwerer Infektionen allerdings erhöht (23 % vs. 15 %). 21
- Immuntherapie: Eine neue Option der Behandlung betrifft den Angriff der Myelomzellen mit geeigneten Antikörpern. Erste Erfahrungen bedürfen jedoch noch einer Überprüfungen durch größere Studien. In kleineren klinischen Studien mit rezidiviertem / refraktärem multiplem Myelom sind Elotuzumab (gegen SLAMF7), Daratumumab (gegen CD38) und Pembrolizumab (gegen PD-1) getestet worden und haben sich als erstaunlich effektiv erwiesen. 22
Therapieziel
Durch eine frühe Diagnosestellung und intensive Therapie wird eine Nichtnachweisbarkeit von residualen Myelomzellen angestrebt: „minimal residual disease negativity“ (MRD-). Diagnostisches Mittel ist die Multiparameter-Durchflusszytometrie, bei der ein Wert < 10-5 angestrebt wird. MRD- bedeutet ein verlängertes progressionsfreies Überleben. Das multiple Myelom kann in vielen Fällen zu einer chronischen Erkrankung mit anhaltender MRD-Negativität werden. 23
→ Auf facebook informieren wir Sie über Neues und Interessantes!
→ Verwalten Sie Ihre Laborwerte mit der Labor-App Blutwerte PRO – mit Lexikonfunktion.
Verweise
Weiteres
- Proc Natl Acad Sci U S A. 2008 Jan 15;105(2):652-6[↩]
- Genes Genomics. 2022 Aug;44(8):957-966. doi: 10.1007/s13258-022-01272-7. [↩]
- Clin Dev Immunol. 2012;2012:196063. Epub 2012 Apr 11[↩]
- Genes Genomics. 2017;39(5):533-540. doi: 10.1007/s13258-017-0518-7.[↩][↩]
- Cancers (Basel). 2022 Aug 26;14(17):4136. DOI: 10.3390/cancers14174136[↩]
- Methods Mol Biol. 2021;2261:151-191. DOI: 10.1007/978-1-0716-1186-9_10[↩]
- Transl Cancer Res. 2020 Mar;9(3):1495-1505. doi: 10.21037/tcr.2020.01.41.[↩]
- JAMA. 2022 Feb 1;327(5):464-477. DOI: 10.1001/jama.2022.0003.[↩]
- JAMA. 2022 Feb 1;327(5):464-477. DOI: 10.1001/jama.2022.0003[↩]
- Clin Lymphoma Myeloma Leuk. 2022 Jul;22(7):460-473[↩]
- Clin Lymphoma Myeloma Leuk. 2022 Jul;22(7):460-473. doi: 10.1016/j.clml.2022.01.011[↩]
- Am J Clin Oncol. 2011 Jun 18. [Epub ahead of print][↩]
- Clin Lymphoma Myeloma Leuk. 2012 Oct;12(5):310-8[↩]
- Blood. 2013 Oct 31;122(18):3122-8[↩]
- J Pharm Pharmacol. 2013 Aug;65(8):1095-106[↩]
- J Clin Oncol. 2012 Jun 1;30(16):1953-9[↩]
- Clin Lymphoma Myeloma Leuk. 2010 Apr;10(2):149-51[↩]
- Drugs. 2014 Feb;74(2):263-71[↩]
- Cancer Res. 2015 Feb 1;75(3):594-604[↩]
- N Engl J Med. 2015 Sep 24;373(13):1207-1219.[↩]
- N Engl J Med 2018; 378:518-528 DOI: 10.1056/NEJMoa1714678[↩]
- Crit Rev Oncol Hematol. 2017 Mar;111:87-93. doi: 10.1016/j.critrevonc.2017.01.011. Epub 2017 Jan 27. PMID: 28259300.[↩]
- Int J Hematol. 2020 Apr;111(4):512-518. DOI: 10.1007/s12185-020-02841-w[↩]