Allgemeines
Das Ösophaguskarzinom ist eine bösartige Neubildung der Speiseröhre. Der Tumor wird meist erst in fortgeschrittenem Stadium endoskopisch entdeckt und mithilfe bildgebender Verfahren und einer histologischen Untersuchung diagnostiziert und eingeteilt (Grading und Staging). Die Behandlung besteht in einer endoskopischen oder chirurgischen Tumorentfernung, wenn das Stadium es zulässt, ansonsten in einer Chemotherapie, kombiniert mit einer Radiotherapie, in geeigneten Fällen ergänzt durch Biologika. 1 Neue Optionen beinhalten eine Immuntherapie des Plattenepithelkarzinoms. 2
Typen
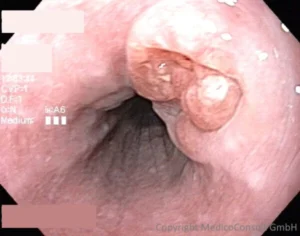
Es werden 2 Typen unterschieden: das Plattenepithelkarzinom (esophageal squamous cell carcinoma, ESCC) und das Adenokarzinom (esophageal adenocarcinoma, EAC). Bedeutende Risikofaktoren für das Ösophaguskarzinom sind Alkohol und Rauchen. Das Karzinom am Übergang vom Magen in die Speiseröhre (esophagogastric junctional adenocarcinoma, EGJ-carcinoma) entsteht infolge einer Refluxkrankheit und ist histologisch ebenfalls ein Adenokarzinom. 3
Häufigkeit
Die Inzidenz (Neuerkrankungen) liegt für Männer bei 6/100000/Jahr, für Frauen bei 1,5/100000/Jahr. Sie nimmt weltweit dramatisch zu. 4 Die Inzidenz des Plattenepithelkarzinoms ist in Europa relativ gering. 5
Ursachen und Entstehung
Je nach Histologie werden unterschiedliche Ursachen angenommen.
Plattenepithelkarzinom (70 %): Von Bedeutung sind hochprozentiger Alkohol und Nikotinabusus. Temperatur scheint ebenfalls eine Rolle zu spielen: Im Iran wurden festgestellt, dass das Risiko, ein Ösophaguskarzinom zu bekommen, um so höher ist, je heißer der Tee getrunken wird. 6
Adenokarzinom (30 %): Das Barrett-Karzinom ist eine häufige Form des Adenokarzinoms. Entscheidend ist bei ihm chronischer Reflux von saurem und galligem Magensaft. Es kommt zu einer metaplastischen Transformation vom normalen Plattenepithel des Ösophagus zu einem prismatischen Epithel. Metaplastisches Epithel bedeutet ein 30- bis 40-fach erhöhtes Krebsrisiko. 7 3
Rauchen: es gilt als ein Hauptrisikofaktor für beide Haupttypen des Ösophaguskarzinoms. Zigarettenrauch enthält mehr als 60 Karzinogene. Wer über 30 Pack-Years geraucht hat, trägt ein 400-faches Risiko. 8
Alkohol: Abbauprodukt ist Acetaldehyd. Dieses interagiert mit DNA und induziert Genmutationen. Alkohol selbst stimuliert die Karzinogenese durch Hemmung der Genmethylierung. 9
Genetische Prädisposition: Eine Reihe von Gen-Mutationen sind mit dem Plattenepithelkarzinom des Ösophagus in Verbindung gebracht worden. 10 11
Tumorsuppressorgen: Es ist ein Gen identifiziert worden, das zur Prognoseabschätzung verwendet werden kann. Das „Esophageal cancer related gene 4 “ (ECRG4) ist im Gewebe eines Ösophaguskarzinoms wesentlich geringer als in normaler Ösophagusschleimhaut oder gar nicht exprimiert. Es wirkt als Tumorsuppressor 12.
Symptomatik
Bemerkbar macht sich das Ösophaguskarzinom durch stadienabhängige Symptome. Schluckprobleme sind für den Lauf der Diagnostik die wichtigsten.
Folgende Symptome sind typisch:
- Dysphagie (Schluckbeschwerden; sie können früh auftreten, werden aber meist erst zu spät Anlass einer Untersuchung),
- Odynophagie (Schmerzen beim Schlucken),
- Speise rutscht nicht: Stase bis hin zum Bolusverschluss,
- gehäufte bronchopulmonale Infekte
- wegen gehäufter Aspiration (Verschlucktes staut sich in der Speiseröhre hoch und gelangt in die Atemwege) und
- wegen ösohagotrachealer Fistelbildung (Verschlucktes gelangt über eine Öffnung, die durch den zerfallenden Tumor zustande kommt, in die Atemwege),
- Gewichtsverlust (durch tumorbedingte Appetitlosigkeit).
Diagnostik
Die Diagnostik des Ösophaguskarzinoms beruht auf direkter Besichtigung durch Endoskopie (Ösophagogastroskopie, ÖGD) und Untersuchung einer im Rahmen der Endoskopie gewonnenen Gewebeprobe (Histologie). Es folgen Umgebungs- und Ausbreitungsuntersuchungen.
- Ösophagogastroskopie: Nachweis von frühen tumorverdächtigen Läsionen und von einengenden (obstruierenden) Prozessen. Gewinnung von Gewebeproben (Probebiopsien) für die Histologie. Nachweis maligner Tumore und prämaligner Veränderungen (chronischer Reflux, Barrett-Schleimhaut).
- Röntgenbreischluck: Nachweis der Tumorausdehnung und einer ösophagotrachealen Fistel (tumorbedingte Öffnung zwischen Luftröhre und Atemwegen).
- Endosonographie zum Staging (Stadieneinteilung): Beurteilung der Tiefe der Wandinfiltration des Tumors und von lokoregionären Lymphknotenmetastasen.
- Computertomographie: zur Beurteilung einer die Ösophaguswand überschreitenden Tumorinfiltration, von lokoregionären Lymphknoten und von Fernmetastasen.
- Röntgen-Thorax und Abdomensonographie zur Metastasensuche.
- Bronchoskopie bei Verdacht auf Fistel vom Ösophagus.
- Expression des Tumorsuppressorgens ECRG4: sie korreliert umgekehrt mit dem Grad der Tumorinvasion, dem Lymphknotenbefall und dem TNM-Stadium. Sie hat daher auch prognostische Bedeutung 13.
Klassifikation
Staging nach dem TNM-Schema (Endosonographie, Computertomographie, MRT). Die Malignität (Histologie) wird in G1 (gut differenziert), G2 (mäßig differenziert) und G3 (schlecht differenziert) eingeteilt. 14
Therapie
Tumoren, die wahrscheinlich R0-resezierbar sind
R0-Resektion bedeutet chirurgische Heilung. Ist sie erwartbar, d. h. ist eine vollständige Entfernbarkeit möglich, so werden folgende Schritte erforderlich:
- Neoadjuvante Strahlentherapie vor Operation: sie ist wahrscheinlich wirksam (Einbindung in Studien gewünscht).
- Operative Therapie. Die Operationstechnik richtet sich nach der Lokalisation. Als Ösophagusersatz kann ein schlauchförmig umgewandelter Magen oder ein Koloninterponat (Teil des Dickdarms, der zwischen oberem und unterem Rand des resezierten Bereichs eingebracht wird) dienen.
- Postoperative Strahlentherapie: sie soll die lokoregionäre Rezidivrate vermindern.
Eine endoskopische Mukosaresektion wird empfohlen, wenn der Tumor nicht größer als 10 mm und auf die Mukosa beschränkt ist, speziell beim Barrett-Karzinom. Größere Tumore können u. U. mit einer endoskopischen Submukosadissektion geheilt werden. Die Präparate werden vollständig auf Invasivität untersucht. 15
Primär nicht resektable Ösophaguskarzinome
- Radiochemotherapie (cis-Platin / 5-FU). Bestrahlung perkutan und per Afterloading von endoluminal möglich. Palliativmaßnahmen umfassen Maßnahmen zur Offenhaltung des Ösophaguslumens (Laserkoagulation, Stenteinlage). 16
Fernmetastasen eines Plattenepithelkarzinoms
Chemotherapie (cis-Platin / 5-FU) mit Remissionsrate von 30 – 40 %.
Fernmetastasen eines Adenokarzinoms
keine einheitliche Empfehlung
Pragmatische Empfehlungen
Als Erstlinientherapie des Ösophaguskarzinoms haben sich sowohl eine Fluoropyrimidin-Platin-Kombination als auch Infusionen mit 5-FU (5-Fluorouracil), Capecitabine und einem Platinpräparat (Cisplatin, Oxaliplatin) bewährt. Der Zusatz von Docetaxel zu 5-FU/Cisplatin wird als eine Option für junge und fitte Menschen betrachtet, hat aber bedeutende Nebenwirkungen auf das Blutbild (Knochenmarkstoxizität) bei nur beschränkter Verbesserung des Überlebens. In Zweit- und Drittlinienkombinationen werden Taxane und Irinotecan eingesetzt. Allerdings führen alle Chemotherapie-Optionen nicht zu einer wesentlichen Verbesserung des Outcomes 17.
Immun-Checkpoint-Inhibitoren
Immuncheckpoint-Inhibitoren haben sich bereits bei vielen Tumoren als wirksam erwiesen – jetzt auch beim Speiseröhrenkrebs (Ösophaguskarzinom). Pembrolizumab (P) bewirkt laut einer Studie beim Plattenepithelkarzinom eine Lebensverlängerung. Sie ist mit durchschnittlich 6,3 Monaten (Chemotherapie plus P) vs. 5,8 Monaten (Kontrollen ohne P) zwar nur gering, aber signifikant. Eine Untergruppe von Patienten (mit positivem Biomarkerstatus bezüglich PD-L1), profitierten etwas mehr (7,5 vs. 5,5 Monate). 18 Wirkprinzip: Pembrolizumab (ein PD-1-Inhibitor) fördert die Erkennung und Bekämpfung von Krebszellen durch das Abwehrsystem des Körpers, indem es die Einflüsse (Signale: PD-L1), welche die Tumorzellen für das Immunsystem unsichtbar machen, nicht wirksam werden lassen.
Eine Studie zeigt, dass bei Plattenepithelkarzinomen, deren Tumorzellen zu mindestens 1% PD-L1 exprimieren, der Zusatz des Anti-PD-L1-Antikörpers Nivolumab das Überleben signifikant gegenüber alleiniger Chemotherapie verlängerte (15,4 vs. 9,1 Monate). Die Rate an Grad 3- und Grad-4-Nebenwirkungen lag bei der Kombination etwas höher als mit Chemotherapie alleine (47% vs. 36%). 19
Nachsorge
Nachsorgeuntersuchungen dienen der frühzeitigen Erkennung von Rezidiven. Es gibt kein akzeptiertes Schema zu einer strukturierten Nachsorge, da ihr Wert umstritten ist.
Prognose
Die Prognose des Ösophaguskarzinoms bezüglich erneutem Auftreten und Überleben nach einer Operation ist umgekehrt abhängig vom der Höhe der Expression des Tumorsuppressorgens ECRG4 (s. o.) 13. Sie beträgt beim fortgeschrittenen inoperablen Karzinom nur wenige Monate. Die Prognose verbessert sich um wenige Monate durch Zusatz von Pembrolizumab zur Chemotherapie (s. o.). 18
→ Auf facebook informieren wir Sie über Neues und Interessantes!
→ Verwalten Sie Ihre Laborwerte mit der Labor-App Blutwerte PRO – mit Lexikonfunktion.
Verweise
Referenzen
- Asian J Surg. 2018 May;41(3):210-215. doi: 10.1016/j.asjsur.2016.10.005.[↩]
- Immunotherapy. 2020 Feb;12(3):203-218. doi: 10.2217/imt-2019-0153[↩]
- Asian J Surg. 2018 May;41(3):210-215. DOI: 10.1016/j.asjsur.2016.10.005. Epub 2016 Dec 13. PMID: 27986415.[↩][↩]
- CA Cancer J Clin, 62 (2012), pp. 118-128[↩]
- CA Cancer J Clin, 61 (2011), pp. 69-90[↩]
- BMJ 2009;338:b929[↩]
- Gastroenterology, 127 (2004), pp. 310-330[↩]
- Cancer Epidemiol, 37 (2013), pp. 579-584[↩]
- Int J Clin Oncol, 15 (2010), pp. 135-144 DOI: 10.1007/s10147-010-0057-6[↩]
- Am J Hum Genet. 2015 Apr 2; 96(4): 597–611. doi: 10.1016/j.ajhg.2015.02.017[↩]
- Am J Hum Genet, 96 (2015), pp. 597-611[↩]
- Cell Oncol (Dordr). 2015 Jun; 38(3):205-14[↩]
- Int J Clin Exp Pathol. 2015 Nov 1;8(11):14772-8. eCollection 2015[↩][↩]
- Radiologia. 2016 Sep-Oct;58(5):352-65. English, Spanish. DOI: 10.1016/j.rx.2016.06.004. Epub 2016 Jul 25. PMID: 27469407.[↩]
- Endoscopy. 2015 Sep;47(9):829-54. DOI: 10.1055/s-0034-1392882. Epub 2015 Aug 28. PMID: 26317585.[↩]
- Surg Today. 2020 Jan;50(1):12-20. DOI: 10.1007/s00595-019-01878-7. Epub 2019 Sep 18. Erratum in: Surg Today. 2020 Apr;50(4):425. PMID: 31535225; PMCID: PMC6952324.[↩]
- Chin Clin Oncol. 2017 Oct;6(5):49. doi: 10.21037/cco.2017.07.06.[↩]
- Lancet Volume 398, ISSUE 10302, P759-771, August 28, 2021 DOI:https://doi.org/10.1016/S0140-6736(21)01234-4[↩][↩]
- N Engl J Med 2022; 386:449-462 DOI: 10.1056/NEJMoa2111380[↩]