Das Wichtigste
| Das Mammakarzinom (Brustkrebs) ist der häufigste bösartige Tumor der Frau. Bei Männern kommt er sehr selten vor. Noch immer sterben etwa 17.000 Frauen jährlich an Brustkrebs, obwohl er sich meist bereits in sehr frühen Stadien erkennen lässt und Risikogruppen leicht zu identifizieren sind. Die frühzeitige Diagnose ermöglicht eine Heilung. Fortgeschrittener Krebs bedarf einer eingreifenden Therapie. Neue Therapieoptionen verbessern die primär schlechte Prognose deutlich. Das Mammakarzinom (Brustkrebs) ist eine bösartige Erkrankung mit großer Vielfalt in Ursache, Entstehung und Verlauf, bei der genetische und nichtgenetische Faktoren eine Rolle spielen. Risikogruppen lassen sich oft bereits durch die Familiengeschichte erkennen. Risikofaktoren:
Diagnostik: Eine frühzeitige Erkennung sowie eine leitliniengerechte Diagnostik und Therapie verbessern die Überlebenschance erheblich. Ziel ist eine möglichst frühe Erkennung eines tumorverdächtigen Herdes. Wenn Tochtergeschwülste (Metastasen) noch nicht aufgetreten sind, kann kurativ (heilend) behandelt werden.
Therapie: Zur Wahl der bestmöglichen Therapie ist eine genaue Ausbreitungsdiagnostik sowie eine Einordnung der Tumorhistologie samt seinen Rezeptoren erforderlich. Von Bedeutung sind hierbei vor allem die Bestimmung der Hormon- und HER2-Rezeptoren auf den Krebszellen. Ansteigende Prognose: Das 5-Jahresüberleben beim primär operablen Mammakarzinom ist durch die neuen Therapiemöglichkeiten bereits auf etwa 90 % angestiegen. Beim fortgeschrittenen Östrogenrezeptor-(ER-)positiven und HER2-negativen Mammakarzinom bewirkt die Kombination von Palbociclib plus Letrozol eine dramatische Verlängerung des progressionsfreien Überlebens (ohne Fortschreiten) auf 24,8 Monate. |
Häufigkeit
Die Inzidenz (Häufigkeit von Neuerkrankungen) des Mammakarzinoms nahm bis etwa 2000 zu, dann allmählich wieder ab und ist seit etwa 2008 konstant. Eine genauere Analyse in den USA zeigt, dass sich dabei 2 Kurven überlagern. Die Inzidenz speziell der Östrogenrezeptor-(ER-)negativen Karzinome nimmt kontinuierlich ab, und zwar seit Beginn der verlässlichen ER-Differenzierung 1992 bis 2016, wohingegen die der ER-positiven wechselnd zu- und abgenommen hat und seit 2008 wieder kontinuierlich zunimmt. Zwischen 2010 und 2019 stieg die Inzidenz jährlich um 0,5 % 2. Eine Prognose besagt, dass die weltweite Belastung durch Brustkrebs bis 2040 auf über 3 Millionen Neuerkrankungen pro Jahr ansteigen wird. 3 Die Sterblichkeit (Mortalität) dagegen nahm in den letzten Jahren auf 1,3 % ab, was auf eine verbesserte Vorsorge und Therapie zurückgeführt wird 4.
Die Gesamtinzidenz liegt etwa bei 200 pro 100.000 Frauenjahre, die Inzidenz der Östrogenrezeptor-(ER-)positiven Tumore bei 170 und die der ER-negativen bei etwa 30.
- Bei ER-Positivität von Frauen der Altersgruppe 30 – 49 Jahre erleben einen kontinuierlichen Anstieg bis auf jetzt etwa 80 pro 100.000 Frauenjahre, die der Altersgruppe 50 – 84 Jahre dagegen eine etwa konstante, aber deutlich höhere Inzidenz von knapp unter 300.
- Bei ER-Negativität dagegen ist der Abfall der Inzidenz bis zum Alter von 49 Jahren deutlich stärker als über 49, und die Inzidenz liegt jetzt bei etwas über 20 bzw. um 60.
Die Menopause erhöht damit die Inzidenz beider Gruppen erheblich und verzögert den Anstieg der Inzidenz ER-positiver Tumore und verlangsamt den Abfall der Inzidenz ER-negativer Tumore 5. Eine weitere Aufschlüsselung nach HER2-Positivität bzw. -Negativität steht noch aus.
Brustkrebsrisiko
Mehr als jede zehnte Frau erkrankt in ihrem Leben an Brustkrebs.
Genetische Prädisposition
Das Brustkrebsrisiko steigt erheblich, wenn genetische Prädispositionen (BRCA1 und BRCA2) nachweisbar sind; in diesen Fällen sind oft junge Frauen betroffen, und manchmal ist eine prophylaktische Mastektomie (Mammaamputation) indiziert. In einer Studie wurde festgestellt, dass bei jungen Frauen mit Mammakarzinom in 12 % (338 von 2733) eine BRCA 1- oder -2-Mutation vorlag, dass aber zuvor nur bei der Hälfte von ihnen (182) solch eine Mutation durch Routinevorsorgeuntersuchungen entdeckt worden war. Dies lässt die Frage aufkommen, bei wem die aufwändige genetische Untersuchung als Vorsorgemaßnahme empfohlen werden soll 6.
Durch genomweite Assoziationsstudien werden immer neue Gene entdeckt, die mit einer Prädisposition für Brustkrebs verbunden sind. 7
Risikofaktoren für das Mammakarzinom sind folgende:
- Rauchen,
- Übergewicht (etwa 2,5-faches Risiko),
- Familiäre (genetische) Belastung: Frauen mit einer Mutation der Breast-Cancer-Gene BRCA1 und BRCA2 haben ein stark erhöhtes Brustkrebsrisiko. Vier Gene mit hoher Penetranz werden oft zusammen getestet: BRCA1, BRCA2, TP53 und CDH1. Auch andere genetische Anomalien sind mit einem gesteigerten Brustkrebsrisiko verbunden (so p53, STK11 oder PTEN). 8
- Schichtarbeit: Hierbei spielt ein Mangel an Melatonin offenbar eine entscheidende Rolle. 9
Assoziationen: Mutationen von BRCA1 und TP53 sind überwiegend mit invasivem duktalem Karzinom assoziiert, BRCA2-Mutationen mit duktalem und mit lobulärem Karzinom. Mutationen von CDH1 (kodiert für das Adhäsionsprotein E-Cadherin) sind mit einem invasivem lobulärem Karzinom assoziiert, nicht jedoch mit einem duktalem Karzinom.
Das Brustkrebsrisiko ist nur sehr fraglich oder nicht erhöht bei:
- Vitamin D und Vitamin D-Mangel: ein bisher angenommener Zusammenhang eines Vitamin-D-Mangels mit dem Mammakarzinom wurde in Zweifel gezogen, 10 Allerdings wird auch vermutet, dass Vitamin D in geringem Maße schützt. 11 Ein hoher Vitamin-D-Status soll schwach mit einem niedrigen Brustkrebsrisiko verbunden sein, dagegen stark mit einem besseren Überleben von Brustkrebs. 12 Die kritische Würdigung der Literaturdaten besagen laut einer Publikation 2022, dass die Wirkung von Vitamin D3 auf die Entstehung von Brustkrebs von vielen Faktoren abhängt, wie Alter, Menopause oder Übergewicht, so dass genauere Studien erforderlich sind 13.
- Phytoöstrogene (z. B. Genistein aus Soja, siehe auch unter Sekundäre Pflanzenstoffe): sie erhöhen das Brustkrebsrisiko nicht 14, sondern senken es eher (siehe hier). Allerdings reagieren Östrogenrezeptor-positive (ER-positive) Karzinome mit Wachstumsförderung, ER-negative dagegen mit erhöhter Wahrscheinlichkeit der Eliminierung. Neu aufgetretene Mammakarzinome von Frauen, die Soja zu sich nehmen, haben überwiegend ER-positive Tumore. 15
Mammakarzinom-Vorsorge
Zur Mammakarzinom-Vorsorge gehören
- Familiengeschichte: wenn Mammakarzinome vorkommen, sollten genetische Marker geprüft werden.
- Vermeidung auslösender Noxen (zum Brustkrebsrisiko s. o.).
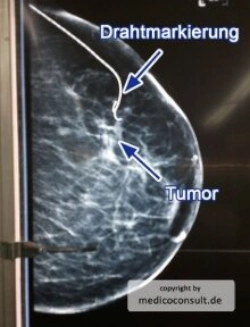
- Rechtzeitige Erkennung verdächtiger Knoten in der Brust durch Selbstuntersuchung und bildgebende Verfahren. Das breite Mammographie-Screening wird allerdings wegen abnehmender Effektivität (in Bezug auf das Überleben) und einer nicht zu vernachlässigenden falsch positiven Krebserkennung kritisch gesehen (siehe hier).
- Medikamente: Hemmer von Östrogenrezeptoren, wie Tamoxifen, Raloxifen oder Lasofoxifen, senken die Brustkrebsinzidenz um etwa 40%. Es wurde berechnet, dass eine Behandlung von 42 Frauen (number needed to treat) innerhalb von 10 Jahren einer Frau die Entwicklung von Brustkrebs erspart; allerdings erhöhte sich die Zahl der thromboembolischen Ereignisse 16. Es wird diskutiert, solch eine Vorbeugung bei postmenopausalen Frauen mit erhöhtem familiärem Brustkrebsrisiko zu empfehlen.
- Genetische Testung: Bei positiver familiärer Vorgeschichte wird eine Testung auf eine genetische Prädisposition empfohlen. Im positiven Fall ist individuell eine prophylaktische Mastektomie zu erwägen. Ein positiver BRCA-Status prädisponiert nach Therapie des Mammakarzinoms zu einem Zweitkarzinom in derselben oder kontralateralen Brust sowie zu einem Ovarialkarzinom. 6 1 17.
Erkennung verdächtiger Knoten
Die Brustkrebsvorsorge erfolgt durch Palpation (auch Selbstuntersuchung), Mammographie und durch die Sonographie der Brust.
Von diagnostischer Bedeutung bei der Untersuchung nicht palpabler, zufällig entdeckter Herde durch die Mammographie sind
- Mikroverkalkungen: sie sind mit dem Mammakarzinom korreliert
- eine unscharfer Begrenzung mit sternförmigen Ausläufern.
Solche Befunde sind i.d.R. Anlass für eine Biopsie zu sicheren Klärung der Dignität.
Wer sollte sich einem Screening unterziehen?
Da das Mammographie-Screening relativ häufig falsch positive Befunde liefert, ist es als Vorsorgemaßnahme in die Diskussion gekommen. Auf jeden Fall sollten sich diejenigen Frauen screenen lassen, die Risikofaktoren aufweisen, wie familiäre Belastung, Adipositas und Rauchen.
Diagnostik des Mammakarzinoms
Ein bereits vorhandenes Mammakarzinom muss hinsichtlich seiner Metastasierung untersucht werden. Metastasen (Tochtergeschwülste) breiten sich zunächst in lokoregionären Lymphknoten der Axilla und des Thorax aus. Sie sind durch Computertomographie meist gut erkennbar. Organmetastasen befinden sich insbesondere in Lungen, Leber und Knochenmark und müssen dort gesucht werden. Folgende Untersuchungsmethoden werden dazu eingesetzt:
- Computertomographie,
- MR-Mammographie,
- Skelettszintigraphie,
- Röntgenuntersuchung der Lungen und der Knochen,
- PET,
- Sonographie der Leber.
Zur Verlaufskontrolle des Mammakarzinoms dienen die Tumormarker CEA (karzinoembyonales Antigen) und CA 15-3.
Histologie
Die feingewebliche Untersuchung (Histologie) des Mammakarzinoms (durch Stanzbiopsie oder Operation gewonnen) ergibt Aussagen zum Tumortyp (intraduktales Karzinom, lobuläres Karzinom) und zur Expression von Hormonrezeptoren. Untersucht wird i.d.R. auf Östrogenrezeptoren (ER), Progesteronrezeptoren (PgR) und HER2-Rezeptoren (einen speziellen Typ von Rezeptoren gegen humanen epidermalen Wachstumsfaktor). Etwa 20-25% der Mammakarzinome ist HER2-positiv, davon exprimiert die Hälfte Östrogen- oder Progesteronrezeptoren. HER2- und ER-positive Tumore machen damit etwa 10% der Fälle aus 18.
Typen
- Das invasive duktale Karzinom ist das häufigste Mammakarzinom; es mach über 2/3 der invasiv wachsenden Mammakarzinome aus.
- Das invasive lobuläre Karzinom macht etwa 10 -15 % aus. Es hat etwa die gleiche Prognose wie das duktale Karzinom.
- Das muzinöse Karzinom ist selten (ca. 2 – 3 %); es hat eine relativ gute Prognose mit eine 10-Jahres-Überlebensrate von über 80 %.
- Das medulläre Karzinom macht 5 – 10 % aus und betrifft eher jüngere Frauen; es hat ebenfalls eine relativ gute Prognose mit eine 10-Jahres-Überlebensrate von um die 80 %.
- Seltene Formen sind das tubuläre Karzinom und das papilläre Karzinom, letzteres fällt oft durch blutige Sekretion aus der Mamille auf. Die Prognosen sind relativ gut.
Rezeptoren
HR: Östrogene regen das Tumorwachstum an, wenn Östrogenrezeptoren im Mammakarzinom vorhanden sind (Hormonrezeptoren, HR+), was in etwa 2/3 der Fälle der Fall ist. Durch Antiöstrogene kann daher das Wachstum gebremst werden. Daher ist der Nachweis der Östrogenrezeptoren von großer Bedeutung.
Progesteron-Rezeptoren: Progesteronrezeptoren induzieren die Bildung des epidermalen Wachstumsfaktorrezeptors (EGF-R, HER) und regen die Vermehrung der Brustkrebszellen an 19.
HER: Sind HER2-Rezeptoren (Rezeptoren für den humanen epidermalen Wachstumsfaktor) immunhistochemisch (oder durch FISH = Fluorescenz-in-situ-Hybridisierung des Her2-Gens) im Mammakarzinom nachweisbar, kommen als Therapie Trastuzumab (Herceptin®) und Pertuzumab (Perjeta®) in Frage. Eine Überexpression an HER2-Rezeptoren, wie sie in bis zu 25 % der Mammakarzinome vorliegt, bedeutet eine starke Wachstumsanregung und damit eine hohe Wachstumsrate. Die stellt ein eher schlechtes prognostisches Zeichen dar. Mit den neuen Antikörpern verbessern sich die Therapiechancen deutlich.
Stadieneinteilung
Das Mammakarzinom wird nach der TNM-Klassifikation eingeteilt. Es werden der Tumor und seine lokale Ausbreitung (T), die Lymphknotenmetastasen (N) und die Fernmetastasen (M) berücksichtigt.
Einteilung des Primärtumors:
- pTx Primärtumor kann nicht beurteilt werden
- pT0 kein Anhalt für Primärtumor
- pTis Carcinoma in situ
- pT1 Tumor 2 cm oder weniger
-pT1a 0,5 cm oder weniger
-pT1b mehr als 0,5 cm, aber nicht mehr als 1 cm
-pT1c mehr als 1 cm, aber nicht mehr als 2 cm - pT2 Tumor mehr als 2 cm, aber nicht mehr als 5 cm
- pT3 Tumor mehr als 5 cm
- pT4 Tumor jeder Größe mit direkter Ausdehnung auf Brustwand oder Haut
-pT4a mit Ausdehnung auf die Brustwand
-pT4b mit Ödem (einschließlich Apfelsinenhaut), Ulzeration der Brusthaut oder Satellitenmetastasen der Haut
-pT4c Kriterien 4a und 4b gemeinsam
-pT4d entzündliches (inflammatorisches) Karzinom
Prognose
Die Überlebensraten beim Mammakarzinom korrelieren umgekehrt mit der Größe des Primärtumors und der Lymphknotenmetastasierung. 20
- Bei einer Tumorgröße von unter 2 cm ohne Lymphknotenmetastasierung liegt sie bei über 95 %.
- Bei einer Tumorgröße von über 5 cm mit über 3 Lymphknotenmetastasen liegt sie bei 45 %.
Wenn Fernmetastasen vorliegen, muss mit einer mittleren Überlebenszeit von 2 – 3 Jahren gerechnet werden.
Der BRCA-Status hat großen Studien zufolge keinen Einfluss auf das 5- und 10-Jahresüberleben. Nach durchschnittlich 8,2 Jahren wurde bei jungen Frauen unter 40 Jahren ein Überleben von 76% gefunden 21. In einer anderen Studie lag das Überleben in einer Studiengruppe im Alter unter 50 Jahren nach 10 Jahren mit BRCA-1-Mutation bei 80,9%, ohne die Mutation bei 82,2% 22.
Eierstockentfernung: Eine BRCA-Positivität erhöht das Risiko für einen erneuten Tumor in derselben oder kontralateralen Brust sowie für ein Ovarialkarzinom. Wenn bei BRCA-positiven brustoperierten Frauen eine Oophorektomie (Eierstockentfernung) durchgeführt wird, verbessert sich daher die Prognose deutlich. In einer Studie reduzierte sich die Sterblichkeit (Mortalität) dadurch signifikant (hazard ratio (HR) 0,41) 23. Auch andere Studien zeigen ebenfalls eine hohe Risikoreduzierung 24.
Untersuchungsbefund
Beim Mammakarzinom findet man je nach Stadium einen tastbaren Knoten, eine eingezogene Mamille, eine Brustverziehung (neu aufgetretene Asymmetrie zur anderen Brust), eine Orangenhaut (Peau d’Orange, bei Hautinfiltration), einen ulzerierenden Tumor, tastbare infraklavikuläre, supraklavikuläre und axilläre Lymphknoten (schmerzlos, bei Lymphknotenmetastasen).
Therapie des Mammakarzinoms
Solange keine Metastasierung vorliegt, kann eine operative Therapie zur Heilung führen. Ist eine Metastasierung nachweisbar, sind i.d.R. Strahlentherapie und Chemotherapie indiziert. Neue Therapien haben die Prognose wesentlich verbessert.
→ Zur Therapie des Mammakarzinoms siehe hier.
→ Auf facebook informieren wir Sie über Neues und Interessantes.
→ Verwalten Sie Ihre Laborwerte mit der Labor-App Blutwerte PRO – mit Lexikonfunktion.
Verweise
- Brustkrebs in Bildern
- Therapie des Mammakarzinoms
- Mammographie – Screening auf Brustkrebs
- Männlicher Brustkrebs
- Tumormarker für Brustkrebs CA 15-3
- Darmkrebs – der häufigste Krebs beider Geschlechter
- Tumorsuche
Weiteres
- Medicine (Baltimore). 2016 Oct;95(40):e4975[↩][↩]
- CA Cancer J Clin. 2022;72:524–41. doi: 10.3322/caac.21754[↩]
- CA Cancer J Clin. 2021;71:209–49. doi: 10.3322/caac.21660.[↩]
- CA Cancer J Clin. 2022;72:524–41. doi: 10.3322/caac.21754.[↩]
- J Natl Cancer Inst. 2011 Sep 21;103(18):1397-402[↩]
- The Lancet Oncology 11 January 2018 DOI: http://dx.doi.org/10.1016/S1470-2045(18)30008-1[↩][↩]
- Nature Genetics 2018; https://www.nature.com/articles/s41588-018-0132-x[↩]
- Breast Cancer Res. 2015 Mar 13;17:37. doi: 10.1186/s13058-015-0546-7[↩]
- EPMA J. 2011 Dec;2(4):351-6. doi: 10.1007/s13167-011-0126-6. Epub 2011 Dec 23[↩]
- Int J Cancer. 2011 Mar 15;128(6):1425-33. doi: 10.1002/ijc.25463.[↩]
- Sci Rep. 2018 Jun 13;8(1):9039. doi: 10.1038/s41598-018-27297-1.[↩]
- Br J Cancer. 2014 May 27;110(11):2772-84. doi: 10.1038/bjc.2014.175.[↩]
- Cancers (Basel). 2022 Jul 27;14(15):3649. DOI: 10.3390/cancers14153649[↩]
- Am J Clin Nutr. 2010 Feb;91(2):440-8[↩]
- Am J Clin Nutr. 2019 Mar 4. pii: nqy313. doi: 10.1093/ajcn/nqy313. [↩]
- Lancet. 2013 May 25;381(9880):1827-34[↩]
- PLoS One. 2017 Oct 6;12(10):e0184181. doi: 10.1371/journal.pone.0184181.[↩]
- Ther Adv Med Oncol. 2016 Nov; 8(6): 429–449[↩]
- Mol Cell Biol. 2007 Jan;27(2):466-80. doi: 10.1128/MCB.01539-06[↩]
- Cancer 1989; 63: 181–187[↩]
- The Lancet Oncology 11 January 2018; DOI: http://dx.doi.org/10.1016/S1470-2045(17)30891-4[↩]
- J Clin Oncol. 2013 Sep 10;31(26):3191-6. doi: 10.1200/JCO.2012.45.3571[↩]
- Breast Cancer Res Treat. 2016 Apr;156(2):371-8. doi: 10.1007/s10549-016-3749-4[↩]
- J Clin Oncol. 2014 May 20;32(15):1547-53. doi: 10.1200/JCO.2013.53.2820.[↩]