Das Wichtigste
| Der Morbus Osler ist eine seltene erbliche, zu Blutungen neigende Fehlbildung kleiner Blutgefäße. Im Laufe des Lebens bilden sich multiple „Blutschwämmchen“ (Gefäßmissbildungen, Angiodysplasien) mit fragilen (brüchigen, verletzlichen) Gefäßwänden auf der Haut, in den Schleimhäuten und oft auch in inneren Organen. Therapie durch Verschorfung blutender Gefäße: Osler-Angiodysplasien sind Ursachen vieler Blutungsereignisse an leicht zugänglichen Stellen des Körpers (Hautblutungen, Nasenbluten, gastrointestinale Blutungen). Im Darmkanal verursachen sie häufig wiederkehrende Sickerblutungen oder auch große Blutungsereignisse, die zu transfusionsbedürftiger Blutarmut (Anämie) führen. Dort sind sie durch Spiegelungsuntersuchungen (Endoskopie) oder mit Hilfe der Kapselendoskopie erkennbar. Endoskopisch erreichbare Herde können in der Regel durch Koagulation verschorft werden. Therapie durch Verschluss zuführender Arterien: Gefäßanomalien kommen auch in inneren Organen vor, so in Leber, Lungen und Gehirn. Dort können sie zu lebensgefährlichen inneren Blutungen führen. Mit Hilfe einer Kathetertechnik lässt sich oft das zuführende arterielle Blutgefäß verschließen, so dass die Blutung zum Stehen kommt. Medikamentöse Therapie: Bevacizumab ist ein Medikament zur Unterdrückung von Gefäßneubildungen. Es wird beim Morbus Osler mit aufschießenden Blutschwämmchen und wiederkehrenden Blutungen erfolgreich eingesetzt. Beispielsweise kann die Zahl von Transfusionen bei Blutungen im Magendarmkanal deutlich verringert werden. Auch eine durch Osler-Herde verursachte rezidivierende Epistaxis (Nasenbluten) lässt sich durch Bevacizumab als Nasenspray deutlich bessern. Thalidomid ist ein weiteres Medikament, das in niedriger Dosierung Wirksamkeit zeigt. |
Allgemeines
Der Morbus Osler (Morbus Osler-Rendu-Weber, engl.: hereditary haemorrhagic telangiectasia, HHT) wird auch als hereditäre hämorrhagische Teleangiektasie (HHT) oder als Morbus Rendu-Osler-Weber (Osler-Weber-Rendu-Syndrom) bezeichnet. Er ist eine seltene erbliche Fehlbildung (Dysplasie, Malformation) des Blutgefäßsystems, die durch Blutschwämmchen auf der Haut und in den Schleimhäuten gekennzeichnet ist und zu Blutungen neigt.
Zusammen mit dem Ehlers-Danlos-Syndrom und dem Marfan-Syndrom gehört der Morbus Osler zu den mesenchymalen Dysplasien. Mit einer Häufigkeit von etwa 1 auf 10.000 1 tritt er häufiger auf, als früher angenommen.
Blutungskomplikationen, wie Nasenbluten und Blutungen im Magendarmkanal, machen häufige Bluttransfusionen und Eiseninfusionen notwendig. 2
Genetik
Der Morbus Osler (hereditäre hämorrhagische Angiodysplasie (HHT) ) ist eine autosomal dominant vererbliche Erkrankung, bei der multiple Gefäßdysplasien (Telangiektasien und große arteriovenöse Malformationen) schon im jugendlichen Alter auftreten. Bei ihr wurden Mutationen in 3 verschiedenen Genen gefunden, die alle eine Fehlfunktion im TGF-ß/BMP-9-Signalweg hervorrufen, was sich auf die Bildung des Blutgefäßsystems auswirkt 3. Am häufigsten werden Mutationen der Gene von Endoglin (verantwortlich für HHT1) und des Activin-A-Rezeptors (verantwortlich für HHT2) gefunden 4.
Erscheinungsbild und Lokalisationen
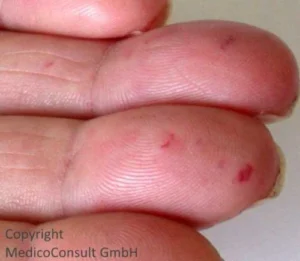
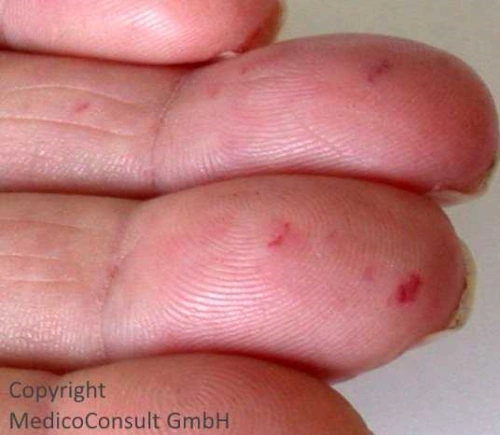
Die Gefäßanomalien sind in ihrer Ausprägung und Lokalisation sehr unterschiedlich. Es handelt sich um arteriovenöse und postkapilläre venöse Malformationen. Erkennbar sind in Haut und Schleimhäuten sog. Teleangiektasien. Dies sind sternförmige Gefäßsprossungen, die von einer zentralen Arteriole ausgehen und zu Blutungen neigen. Sie finden sich besonders in der Haut, den Schleimhäuten und dem Körperinneren, wo sie auch große arteriovenöse Malformationen bilden können.
Gefäßmalformationen im Körper: Größere Gefäßmissbildungen finden sich nach einer Zusammenstellung 5
- in den Lungen (etwa 40 – 60 %),
- in der Leber (etwa 40 – 70 %),
- im Gehirn (etwa 10 %),
- im Rückenmark (etwa 1 %).
Gefäßmalformationen an der Haut: Charakteristisch sind Teleangiektasien an Ohrmuscheln, Lippen, Zungenspitze, Backenschleimhaut und Fingerspitzen (auch unter den Fingernägeln).
Klinische Symptomatik
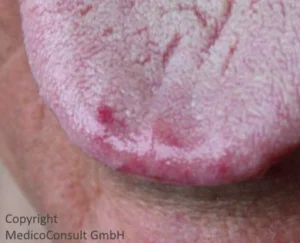
Blutungen: In den allermeisten Fällen kommt es zu mehrfachen Blutungen aus Gefäßmissbildungen in Schleimhäuten, so zu
- rezidivierendem Nasenbluten (in über 90% der Fälle) und zu
- gastrointestinalen Blutungen (in bis zu 25% der Fälle).
Bereits im Alter von 10 Jahren haben etwa die Hälfte der Genträger Nasenbluten erlitten, im Alter von 21 Jahren schon bis zu 90% 6.
Die Blutungen können chronisch verlaufen und zu einer ausgeprägter Eisenmangelanämie führen 7. Sie können aber auch akut und lebensbedrohlich verlaufen.
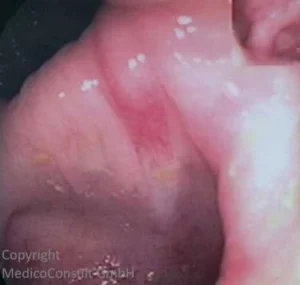
Lebensbedrohliche Lungen- oder Hirnblutungen treten in etwa 50% der Fälle auf 8. Ein spontaner Hämatothorax (Blut im Pleuraspalt ohne Trauma) ist dabei nicht ungewöhnlich 9.
Hirnabszesse mit Schlaganfall-ähnlichen neurologischen Ausfällen sind eine ungewöhnliche, aber wichtige Komplikation pulmonaler arteriovenöser Malformationen. Eine Leukozytose kann fehlen; Blutkulturen können steril bleiben. Bei nicht rechtzeitiger Diagnose ist die Mortalität hoch 10.
Leberkomplikationen: Größere Gefäßmalformationen können zu einer portalen Hypertension und zu Blutungen in die freie Leibeshöhle führen. Dadurch kann eine Transplantationsindikation erwachsen 11.
Schweregrad
Für den Schweregrad von Nasenblutungen beim Morbus Osler wurde ein Score entwickelt. In ihn gehen Frequenz, Intensität und Dauer der bisherigen Blutungsepisoden ein 12.
Für den Gesamtschweregrad der Gefäßmalformationen wurde ebenfalls ein Score entwickelt. Er dient dazu, die Prognose genauer festzulegen. Bei Gruppen mit milder, moderater und schwerer Ausprägung ist die Prognose als zunehmend schlechter anzusetzen 8.
Diagnostik
Nasenbluten: Der erste Hinweis auf einen Morbus Osler ist in den meisten Fällen rezidivierendes Nasenbluten. Eine Inspektion der Nasenschleimhaut durch den HNO-Arzt führt zum Befund einer Gefäßmalformation. Wenn zudem an den typischen Prädilektionsstellen der Haut (s. o.) Teleangiektasien nachweisbar sind, so steht die Diagnose eines Morbus Osler bereits weitgehend fest.
Eine unerklärte Eisenmangelanämie kann ebenfalls zur Diagnose einer Gefäßdysplasie führen. Häufig ist eine offene oder verborgene Magendarmblutung die Ursache. Sie wird durch einen Stuhltest erkannt (positiver FOBT). Daraufhin wird in der Regel der gesamte Magendarmkanal nach blutungsbereiten Gefäßmissbildungen abgesucht. Dafür stehen verschiedene endoskopische Verfahren zur Verfügung. Eine Magen– und Dickdarmspiegelung (oft in gleicher Sitzung durchgeführt) erreicht einen großen Teil der möglichen Lokalisationen einer Blutungsquelle. Nach Erkennung einer Osler-Teleangiektasie kann gleich eine Verschorfung durchgeführt werden kann. Als Übersicht über den Dünndarm eignet sich die Kapselendoskopie. Dazu siehe hier.
Bildgebende Verfahren: Steht ein Morbus Osler im Raum, so sind auch Leber, Lungen und Gehirn bezüglich Gefäßmalformationen zu untersuchen. Dazu werden bildgebende Verfahren mit Kontrastmitteln (CT, MRT, Sonographie) verwendet.
Genetische Diagnostik: Die Diagnose lässt sich heute in Zweifel durch Nachweis bekannter genetischer Mutationen leicht sichern 13. Häufige Mutationen betreffen ENG, ACVRL1/ALK1 und MADH4/SMAD4, die zu abnormen Spiegeln an TGF-ß (transforming growth factor β) führen. 14
Familienscreening: Die Diagnose lässt sich weiter festigen, wenn sich eine familiäre Häufung von Nasenbluten und Blutungen aus dem Magendarmtrakt erfragen lässt. Umgekehrt sollte ein starker Verdacht auf einen Morbus Osler dazu führen, enge Blutsverwandte in eine Screening-Diagnostik einzubeziehen.
Therapie
Elektrokoagulation: Blutende Gefäßmalformationen werden verödet (z. B. durch Elektrokoagulation: Sklerotherapie). Dies lässt sich in der Nasenschleimhaut sowie im oberen und unteren Magendarmtrakt endoskopisch meist gut erreichen. Im mittleren Magendarmtrakt ist die Erreichbarkeit eingeschränkt. Wenn eine gute Einstellung durch Endoskopie bzw.. Pushenteroskopie nicht möglich ist, sind angiographische und operative Methoden zu diskutieren.
Gefäßverschluss durch Kathetertechniken: Gefäßmalformationen in den Lungen können kathetertechnisch durch Embolisation behandelt werden, was bei einer akuten großen Lungenblutung lebensrettend sein kann 15 16 17.
Hemmung der Gefäßneubildung
Inzwischen gibt es Erfahrungen mit verschiedenen Medikamenten, die zu einer Reduktion der Blutungsneigung führen. 2 Zu ihnen gehören folgende:
Bevacizumab
Bevacizumab ist ein menschlicher Antikörper, der Gefäßneubildungen hemmt (siehe hier). -VEGF-Antikörper (VEGF = vascular endothelial growth factor), der in kleinen Beobachtungsstudien zu einer deutlichen Reduktion der Blutungshäufigkeit bei Epistaxis (Nasenbluten) 18 19 20 und einer Besserung von Leberkomplikationen 11 geführt hat.
Auch für gastrointestinale Blutungen wird in Bevacizumab eine Therapieoption gesehen 21. Es senkt die Transfusionshäufigkeit deutlich 22. Selbst bei einem Patienten mit schweren rezidivierenden gastrointestinalen Blutungen führte Bevacizumab 5 mg/kg alle 2 Wochen zu einer deutlichen Reduktion von Transfusionen (Einsparung von etwa 300 Erythrozytenkonzentrate pro Jahr) 23.
Eine ähnlich positive Bilanz wurde mit intermittierender Behandlung mit Bevacizumab eine geringeren Dosis von 1 mg/kg alle 2 Wochen erzielt: es wurden etwa 100 Erythrozytentransfusionen eingespart 24.
Bevacizumab-Nasenspray zeigte in Studien bei kurzfristigen Anwendung keinen signifikanten Nutzen bei Nasenbluten 25.
Thalidomid
Niedrig dosiertes Thalidomid (zwischen 25 und 150 mg/d), welches Gefäßneubildungen hemmt (antiangiogenetische Wirkung), führte in einer Studie an 31 Patienten zu einem Ansprechen bei allen, bei 28 von ihnen schon bei der geringsten Dosis. Drei Patienten hatten ein vollständiges Ansprechen (Blutung gestoppt), 28 ein teilweises. Die Verträglichkeit war gut. Nur Grad-1-Nebenwirkungen kamen vor, meist Verstopfung, periphere Ödeme und Schläfrigkeit. 26
Eine ähnliche Aussage hat eine chinesische Studie, bei der orale Tagesdosen von 100 oder 50 mg gegen Placebo für 4 Monate verabreicht und der Erfolg über mindestens 1 Jahr verfolgt wurde. Der Prozentsatz der Patienten mit einem wirksamen Ansprechen (Reduktion der Blutungsepisoden > 50 %) in den einzelnen Gruppen betrug 68,6 %, 51,0 % und 16,0 %. 27
Pazopanib
Pazopanib ist ein oraler Multi-Kinase-Angiogenese-Hemmer. Er hat sich in Fallstudien zur Behandlung von Blutungen bei HHT als geeignet erwiesen. Er war auch in einigen Fällen wirksam, in denen Bevacicumab versagte. Die Eisensubstitution und die Transfusionshäufigkeit konnte um über 90 % reduziert werden. Die Verträglichkeit war gut. Unter den Nebenwirkungen waren Hypertonie, Lymphozytopenie und Müdigkeit die häufigsten. 28.
Aflibercept
Aflibercept ist, wie Bavacicumab, gegen VEGF gerichtet. In einer Publikation wurde mitgeteilt, dass es in einem Fall eines Nachlassens der Bevacicumab-Wirkung wirksam blieb, ohne dass schwerwiegende unerwünschte Ereignisse auftraten 29.
Somatostatin-Analoga
Somatostatinanaloga können Blutungen bei hereditären hämorrhagischen Teleangiektasien (HHT) reduzieren. Ihre Anwendung wird gut vertragen und ist in vielen Fällen auf Dauer wirksam 30 31.
Tyrosinikanse-Inhibitoren
Weitere Medikamente mit Wirkung auf die arteriovenösen Gefäßfehlbildungen und Reduktion des mit ihnen verbundenen Blutverlusts sind Tyrosinkinase-Inhibitoren wie Sorafenib. 32. Sie zielen auf Rezeptortyrosinkinasen wie VEGF-Rezeptoren (VEGFRs) und können möglicherweise zur Behandlung verwendet werden. Im Tiermodell war Sorafenib jedoch bezüglich einer Rückbildung der Malformationen nur teilweise erfolgreich 33.
→ facebook: Neues und Interessantes!
→ Labor-App Blutwerte PRO – mit Lexikonfunktion
Verweise
Weiteres
- J Intern Med. 1999 Jan;245(1):31-9[↩]
- Genes (Basel). 2021 Jan 27;12(2):174. DOI: 10.3390/genes12020174.[↩][↩]
- Am J Hum Genet. 2013 Sep 5;93(3):530-7[↩]
- Front Genet. 2015 Jan 26;6:1. doi: 10.3389/fgene.2015.00001.[↩]
- J Blood Med. 2014 Oct 15;5:191-206[↩]
- Front Genet. 2015 Jan 26;6:1. doi: 10.3389/fgene.2015.00001[↩]
- Trans Am Clin Climatol Assoc. 2004; 115: 185–199[↩]
- Orphanet J Rare Dis. 2014 Dec 29;9:188. doi: 10.1186/s13023-014-0188-3[↩][↩]
- J Thorac Dis. 2015 Mar;7(3):520-6[↩]
- Am J Med. 1984 Jul;77(1):86-92[↩]
- Liver Transpl. 2008 Feb;14(2):210-3[↩][↩]
- Laryngoscope. 2010 Apr;120(4):838-43[↩]
- Front Genet. 2015 Jan 26;6:1. doi: 10.3389/fgene.2015.00001. eCollection 2015.[↩]
- J Clin Lab Anal. 2022 Aug;36(8):e24571. DOI: 10.1002/jcla.24571[↩]
- Int J Cardiol. 2004 Oct;97(1):135-7[↩]
- J Thorac Imaging. 2008 Nov;23(4):295-7[↩]
- Chest. 2010 Mar;137(3):705-7. doi: 10.1378/chest.09-0344[↩]
- N Engl J Med. 2009 May 14;360(20):2143-4.[↩]
- Laryngoscope. 2012 Jun;122(6):1210-4[↩]
- Laryngoscope. 2012 May;122(5):953-5[↩]
- Clin Med Res. 2015 Mar;13(1):32-5[↩]
- Hum Vaccin Immunother. 2015;11(3):680-1[↩]
- World J Gastrointest Surg. 2016 Dec 27; 8(12): 792–795. doi: 10.4240/wjgs.v8.i12.792[↩]
- Wien Klin Wochenschr. 2017 Feb;129(3-4):141-144. doi: 10.1007/s00508-016-1124-4[↩]
- JAMA. 2016 Sep 6;316(9):943-51. doi: 10.1001/jama.2016.11724[↩]
- Lancet Haematol. 2015 Nov;2(11):e465-73. doi: 10.1016/S2352-3026(15)00195-7[↩]
- N Engl J Med. 2023 Nov 2;389(18):1649-1659. DOI: 10.1056/NEJMoa2303706[↩]
- Angiogenesis. 2022 Feb;25(1):87-97. doi: 10.1007/s10456-021-09807-4[↩]
- Medicina (Kaunas). 2023 Aug 24;59(9):1533. doi: 10.3390/medicina59091533[↩]
- Front Med (Lausanne). 2023 May 12;10:1146080. doi: 10.3389/fmed.2023.1146080[↩]
- Endosc Int Open. 2023 Dec 15;11(12):E1145-E1152. doi: 10.1055/a-2190-9303[↩]
- Genes (Basel). 2021 Jan 27;12(2):174. DOI: 10.3390/genes12020174. [↩]
- J Thromb Haemost. 2017 Jun;15(6):1095-1102. doi: 10.1111/jth.13683[↩]