Die Therapie des Mammakarzinoms hat sich entscheidend weiterentwickelt. Solange keine Metastasierung vorliegt, kann eine operative Therapie zur Heilung führen. Ist eine Metastasierung nachweisbar, sind i. d. R. Strahlentherapie und Chemotherapie die besten Optionen. Inzwischen haben auch Biologika einen hohen Stellenwert erhalten, und die Behandlung wird zunehmend individualisiert.
Operative Therapie
In Frühstadien des Mammakarzinoms kann eine brusterhaltende Operation durchgeführt werden (Tumorexstirpation, Segmentresektion, Quadrantenresektion). Voraussetzungen sind in der Regel ein fehlender Nachweis von Haut- und Muskelinfiltrationen und von Metastasen und eine Tumorgröße nicht über 2 cm. Ein inflammatorisches Karzinom kommt für eine Brusterhaltung ebenfalls nicht in Frage.
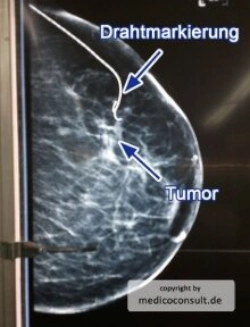
Ein nicht palpabler Tumor wird präoperativ (z. B. sonographisch durch eine Farbstoffinjektion oder einen Draht) markiert. Es werden etwa 2/3 der Mammakarzinom-Operationen brusterhaltend durchgeführt.
Entfernung des Wächterlymphknotens:
Vor einer geplanten Chemotherapie wird meitens der Wächterlymphknoten (sentinel lymph node, SLN) entfernt, da er danach nicht mehr absolut sicher erkannt werden kann. Durch Injektion eines Farbstoffs in den Tumor färben sich die im Lymphabstomgebiet liegenden Lymphknoten intravital an, so dass der „Wächterlymphknoten“ intraoperativ erkannt und reseziert werden kann. Weist er Tumorzellen auf, ist von einer Metastasierung auszugehen. Zur operativen Therapie gehört je nach Situation auch ein neuer Brustaufbau mit körpereigenem Gewebe oder einer Silikonunterfütterung.
Strahlentherapie
Eine lokale Strahlentherapie des Mammakarzinoms wird gewählt, wenn brusterhaltend operiert wurde, und wenn der Tumor operativ nicht vollständig entfernt werden konnte, wenn er beispielsweise infiltrierend in die Muskulatur vorgewachsen ist. Auch können günstig liegende Lymphknotenmetastasen ins Strahlenfeld einbezogen werden. Bestrahlungsbeginn ist i. d. R. erst nach Abheilung der Operationswunde, d. h. nach ca. 3 bis 4 Wochen. Die Bestrahlung dauert etwa 5 bis 6 Wochen bei 5 Sitzungen pro Woche je 2 Gy. Knochenmetastasen können ebenfalls durch Strahlentherapie stabilisiert werden.
Medikamentöse Therapie
Die Chemotherapie des Mammakarzinoms umfasst die klassischen Chemotherapeutika und zudem Prinzipien, die die Östrogenwirkung im Körper unterdrücken, sowie Antikörper gegen HER2-Rezeptoren.
Chemotherapie
Es gibt verschiedene tumorwirksame, aber toxische Regime. Sie beinhalten Kombinationen von z. B. Cyclophosphamid, Methotrexat, 5-FU, Epirubicin bzw. Adriamycin, Gemcitabine, Docetaxel, Capecitabine und Oxaliplatin. Die häufigsten Nebenwirkungen betreffen Übelkeit, Diarrhö, Haarausfall, Nieren- und Leberschäden sowie eine Knochenmarkschädigung mit Entstehung einer Anämie. Die Wahl der Chemotherapie erfolgt individuell; die Nebenwirkungen werden dabei berücksichtigt.
Gängig ist das CMF-Schema bestehend aus Cyclophosphamid, Methotrexat und 5-Fluorouracil. Weitere Schemata sind EC bzw. AC (Epirubicin bzw. Adriamycin zusammen mit Cyclophosphamid), FEC bzw. FAC (zusätzlich zu EC bzw. AC noch 5-Fluorouracil). Ein Therapieschema beinhaltet beispielsweise Capecitabine und Docetaxel. In Studien wird die Kombination ergänzt durch Trastuzumab. 1 Bei hohem Risiko wird eine Kombination aus Epirubicin, Cyclophosphamid und Paclitaxel in Verbindung mit Tislelizumab, einem PD-1-Hemmer, bei dreifach negativem Brustkrebs als Option angeführt 2.
Beeinflussung der Östrogenwirkung
Eine gegen die Wirkung von Östrogen gerichtete Therapie kommt in Betracht, wenn in der Tumorhistologie Östrogenrezeptoren auf den Tumorzellen nachweisbar sind. Bei Östrogenrezeptor-positiven Tumoren (ER+) werden folgende Prinzipien ausgenutzt:
- Antiöstrogene, wie Tamoxifen, wirken am Östrogenrezeptor ER-positiver Tumorzellen und hindern die körpereigenen Östrogene an ihrer proliferationsfördernden Wirkung. Die günstige Wirkung von Tamoxifen bezüglich Verlängerung des Überlebens bei primär operablen Tumoren ohne axilläre Lymphknoten ist nur auf eine Einnahmezeit von 5 Jahre beschränkt; die Wirkung eine 5-Jahrestherapie hielt in einer Studie jedoch über 10 Jahre an (krankheitsfreies Überleben 69 % vs. 57 %, Gesamtüberleben 80 % vs. 76 %, Reduktion der Inzidenz eines kontralateralen Mammakarzinoms um 37%) 3 4.
- Senkung der körpereigenen Östrogenproduktion durch
– Gestagene,
– Aromatasehemmer: Aromatasen wandeln die Östrogenvorstufe Androstendion in Östrogene um; sie finden sich in Muskel-, Fett- und Brustdrüsengewebe auch noch nach der Menopause, nicht in den Ovarien, sie sind vor allem nach der Menopause einzusetzen! Dazu siehe hier.
– GnRH-Analoga: Diese Medikamente sich dem Gonadotropin-Releasing-Hormon der Hypophyse nachgebildet. Sie unterdrücken den stimulierenden Einfluss der Hypophyse auf die körpereigene Östrogenproduktion.
– Ovarektomie (Oophorektomie): Vor der Menopause werden die Eierstöcke (Ovarien: der hauptsächliche Bildungsort der Östrogene) operativ entfernt. Eine Ovarektomie wird heute nur noch selten durchgeführt, da es inzwischen wirksame medikamentöse Östrogenhemmer (z. B. Aromatasehemmer) gibt.
Therapiewahl abhängig vom Eintritt der Menopause
Die Wahl der antihormonellen Therapie hängt davon ab, ob das Mammakarzinom vor oder nach Erreichen der Wechseljahre aufgetreten ist. Bei Therapie vor den Wechseljahren können durch eine die Östrogenwirkung hemmende Behandlung Beschwerden wie in den Wechseljahren (Hitzewallungen, Stimmungslabilität, gelegentlich auch Übelkeit) auftreten.
Hemmung von Wachstumsfaktoren
Die Therapieoptionen sind wesentlich errweitert worden, indem zielgerichtet in die Signalwege der hormonellen Wachstumsfaktoren eingegriffen werden kann, die die Ausbreitung des Tumors induzieren. Es handelt sich im Wesentlichen um die Wirkung von Östrogenen, Progesteron und dem epidermalen Wachstumsfaktor HER2. In etwa 25 % sind jedoch diese Faktoren negativ („triple negative breast cancer“) 5.
Thyrosinkinaseinhibitoren: Lapatinib (Tyverb®, Einnahme in Tablettenform) ist ein reversibler Tyrosinkinasehemmer des epidermalen Wachstumsfaktor-Rezeptors (EGFR) und gleichzeitig des „human epidermal growth factor receptor-2“ (HER2). In Kombination mit Capecitabin führte es beim metastasierenden Mammakarzinom zu einer deutlichen Verlängerung der progressionsfreien Zeit von 4,4 auf 8,4 Monate. 6 7 8
Kombination eines Kinasehemmers mit einem Aromatasehemmer: Die Kombination von Ribociclib und Letrozol ist als Erstlinienbehandlung laut einer Studie einer alleinigen Therapie mit Letrozol deutlich überlegen; das gilt für fortgeschrittene HR-positive, HER2-negative Tumore. Über eine mittlere Nachverfolgungszeit von 6,6 Jahren senkte die Kombination die Sterberate von 65,6% auf 54,2%. Das mittlere Überleben stieg von 51,4 Monate auf 63,9 Monate. Es traten keine zusätzlichen Nebenwirkungen auf. Erklärung: Ribociclib ist ein Kinaseinhibitor (CDK4/6; Kinasen übertragen Phosphat z. B. von ATP auf andere Substrate); Letrozol ist ein Aromatasehemmer (unterdrückt die Bildung von Östrogen). 9
Beeinflussung der Wirkung des humanen epidermalen Wachstumsfaktors: In 25% der Mammakarzinome findet sich eine Überexpression von HER2 (human epidermal growth factor receptor 2). Antikörper gegen HER2-Rezeptoren (s.o.), wie Trastuzumab (Herceptin ®) und Pertuzumab (Perjeta®), bewirken eine Unterbrechung der Signalkaskade für die Zellteilung bereits an der Zelloberfläche. Der Antikörperbesatz der Rezeptoren bewirkt zudem auch eine Markierung der Tumorzellen für zytotoxische Lymphozyten (Killerzellen), die dort andocken und eine gezielte Abtötung der Tumorzellen einleiten. Voraussetzung für die Behandlung des metastasierenden Mammakarzinoms mit HER2-Antikörpern ist der Nachweis einer Überexpression der HER2-Rezeptoren im Tumorgewebe.
- Bei einer inoperablen Ausgangssituation scheint die zusätzliche Medikation von Trastuzumab zu einer Chemotherapie (Capecitabine-Doxetacel) einen Vorteil zu haben; die Ansprechrate war im Therapiearm mit Trastuzumab deutlich höher als in dem ohne. 1
- Eine duale Therapie beider HER2-Antikörper ist noch erfolgreicher: bei HER2-positivem metastasierenden Brustkrebs erzielte die Ergänzung von Pertuzumab zur Kombination von Trastuzumab und Docetaxel eine Verlängerung des mittleren progressionsfreien Überlebens von 12,4 (ohne Pertuzumab) auf 18,7 Monate. 10
Apoptosehemmer
mTOR-Hemmer
mTOR-Hemmer haben eine Bedeutung für die Therapie des Mammakarzinoms durch den Nachweis erhalten, dass sie die Apoptose (programmierter Zelltod) und Autophagie von Tumorzellen erhöhen 11. Besonders häufig (etwa 50%) reagieren sog. „triple negative breast cancers“ günstig (TNBC, charaktersiert durch Alterationen im PI3K/AKT/mTOR-Signalweg) 12.
Capivasertib ist ein AKT-Hemmer, der zusammen mit Fulvestrant, einem Hemmer der Östrogenrezeptorfunktion bei sonst austherapierten HR+/HER-neg. Tumoren lebensverlängernd wirkt. 13
Bei HR-positiven/HER2-negativen Tumoren wirkt Alpelisib laut einer Studie erstaunlich gut: Noch bei fortgeschrittenem Krebs verlängerte sich die Zeit ohne Tumorwachstum von 5,7 auf 11 Monate (progressionsfreie Überlebenszeit). Alpelisib ist ein neuer PI3Kα-spezifischer Inhibitor, der den mTOR-Weg durch Hemmung einer überaktiven initiierenden Kinase ausbremst 14 15.
Unterbrechung des Zellzyklus
CDK4/6-Hemmer sind eine neue Substanzgruppe, die an einer zentralen Stelle im Zellzyklus angreift. Erklärung: RB (Retinoblastom-Protein) regelt das Zusammenspiel von Autophagie und Apoptose. 16 und unterdrückt Zellteilungsvorgänge. Seine Funktion ist bei vielen Tumoren durch seine übermäßige Phosphorylierung gestört. Diese wird durch CDK4/6 (cyclin-dependent kinase 4/6) vermittelt. Eine Hemmung von CDK4/6 führt zu einer Verminderung der RB-Phosphorylierung und damit zu einer erhöhten Hemmwirkung auf den Zellzyklus. 17
Palbociclib (PD0332991) ist ein selektiver und sehr potenter CDK4/6-Inhibitor, der den Zellzyklus in der G0/S1-Phase (Ruhephase / Synthesephase) unterbricht und auf diese Weise das Fortschreiten (die Progression) verschiedener Tumore, insbesondere des Mammakarzinoms hemmt 18.
Palbociclib plus Letrozol (ein Aromatasehemmer, s. o.) bewirken laut einer Studie beim fortgeschrittenen, bisher noch nicht behandelten ER-positiven und HER2-negativen Mammakarzinom (Östrogenrezeptoren vorhanden, „human epidermal growth factor receptor 2“ nicht nachweisbar) postmenopausaler Frauen einen wesentlichen Vorschritt im Überleben. Das progressionsfreie Überleben wird durch diese Kombination signifikant über das von Letrozol alleine (24,8 vs. 14,5 Monate) erhöht. Nebenwirkungen waren Leukopenie (24.8 % vs. 0 %), Anämie (5.4 % vs. 1.8 %) und Müdigkeit (1.8 % vs. 0.5 %) 19.
Ribociclib, ein CDK4/6-Hemmer, ist bei Brustkrebs wirksam: Das mittlere Überleben von Frauen mit Hormon-positiven plus HER2-negativen Tumoren, die zusätzlich zur antihormonellen Behandlung Ribociclib erhielten, lag nach 42 Monaten bei 70,2 % (vs. 46,0 %): d.h. etwa 30 % weniger Frauen starben in diesem Zeitraum. 20
- Bei prä- und perimenopausalen Frauen wurde festgestellt, dass Ribociclib zusätzlich zu einer Hormontherapie (Goserelin plus ein nichtsteroidaler Aromatasehemmer oder Tamoxifen) das mittlere Überleben von 48 Monaten auf 58,7 Monate verlängerte. Nach 48 Monaten lag das Überleben bei 60 % vs. 50 %. 21
- Bei postmenopausalen Frauen mit HR-positivem, HER2-negativem fortgeschrittenen Brustkrebs wurde Letrozol plus Ribociclib vs. plus Placebo getestet. Das mediane Gesamtüberleben betrug mit Ribociclib 63,9 Monate vs. 51,4 Monate mit Placebo. 22
Behandlung des „Triple-Negative-Breast Cancer“
Sacituzumab: Etwa 1/5 der Mammatumore ist „triple negative“ (negativ für Rezeptoren für Östrogen, Progesteron und den Wachstumsfaktor HER2). Betroffene mit diesem Typ, bei denen eine Operation nicht mehr möglich ist, können noch mit einem auf die Apoptose gerichteten Therapieschema (PD-1- / PD-L1-Inhibitoren) behandelt werden. Wenn solch eine Behandlung nicht möglich ist, kam bisher nur noch eine Platin-basierte Chemotherapie infrage. Jetzt wurde mit Sacituzumab eine neue Option eröffnet. Sie ermöglicht eine durchschnittliche Progressionsfreiheit von 9,7 Monaten (vs. 6,9 Monate unter Chemotherapie). Unter den schweren Nebenwirkungen trat am häufigsten ein Mangel an neutrophilen Leukozyten auf (43%, vs. 41%). Nebenwirkungen führten in 4% (vs. 12%) zum Therapieabbruch. 23 Sacituzumab Govitecan ist ein Antikörper-Topoisomerase-Inhibitor-Wirkstoffkonjugat. Es zielt auf den Trop-2-Rezeptor, der das Krebswachstum anregt. Der Antikörper ist mit einem Topoisomerase-Inhibitor verbunden, der auf Krebszellen toxisch wirkt.
Vorsicht bei einer Behandlung mit Glukokortikoiden
Bösartige Tumore sind oft nicht einheitlich in ihren Eigenschaften; manche setzen besonders leicht Tochtergeschwülste (Metastasen) ab, deren Wachstum wiederum ganz unterschiedlich ausfallen kann. Bekannt ist dies beispielsweise für den Brustkrebs. Es wurde gezeigt, dass deren Fernmetastasen eine erhöhte Rezeptoraktivität bezüglich Kortison aufweisen. Wird seine Wirkung gehemmt, sinkt die Metastasenbildung, und es steigt das Überleben im Tiermodell. Die Autoren warnen daher vor Kortisonpräparaten bei Brustkrebs-Patienten. 24
Behandlung eines T1-Mammakarzinoms
Beobachtungsstudien besagen, dass in einem frühen Tumorstadium (T1N0M0) eine brusterhaltende Therapie einer Mastektomie überlegen oder zumindest gleichwertig bezüglich des Überlebens ist. 25 Dies gilt auch für die aggressivere triple-negative Form im Vergleich mit Hormon-positiven Formen. Das 5-Jahresüberleben lag nach partieller Brustoperation um 88,6 %, nach Mastektomie bei 83 % und 79,6 % nach Mastektomie und Nachbestrahlung. 26
Frauen mit lokal beschränktem Brustkrebs (Stadium T1 oder T2) wird inzwischen meistens eine brusterhaltende Operation empfohlen. Wegen einem möglichen Lymphknotenbefall wird oft ein Eingriff in der Achselhöhle durchgeführt. Es steht jedoch infrage, ob er notwendig ist. Denn ein axillärer Eingriff bedeutet ein, wenn auch geringes Risiko für einen Lymphstau im Arm (Lymphödem), Bewegungseinschränkungen und Schmerzen in der Axel. Eine große Studie besagt, dass das tumorfreie Gesamtüberleben bei Verzicht auf einen axillären Eingriff nicht niedriger, sondern gleich hoch ist. Es betrug nach 5 Jahren 91,9 % (vs. 91,7 %). Allerdings traten in dieser Gruppe axilläre Rezidive in 1,0 % (vs. 0,3 %) auf. 27
Therapieempfehlungen der AGO
Die AWMF-Leitlnie läuft im November 2022 aus. Neue Leitlinienempfehlungen der Arbeitsgemeinschaft Gynäkologische Onkologie (AGO) geben Hinweise für die Behandlung des Mammakarzinoms unter Berücksichtigung der aktuellen Studien. 28
Symptomatische und unterstützende Therapie
Die Therapie des Mammakarzinoms berücksichtigt folgende Symptome und Bedingungen:
- Knochenschmerzen bei Knochenmetastasen (auch als Nebenwirkung von Aromatasehemmern, s.o.): es werden oft Bisphosphonate erfolgreich eingesetzt. Zudem werden Schmerzmittel verwendet (Schmerzprotokoll).
- Lymphabflussstörung des Arms nach Entfernung axillärer Lymphknoten: es kommen Lymphdrainagen zur Anwendung.
- Anämie: ggf. müssen Bluttransfusionen überbrücken. Ggf. Anregung der Blutbildung durch Eisen (unter Beobachtung des Anstiegs der Retikulozyten)
- körperliche Aktivität: sie scheint als unterstützende Maßnahme günstig zu wirken!
- psychische Stabilisierung: eine Psychoonkologin gehört zu jedem Brustkrebszentrum hinzu und hilft, die Erkrankung zu verarbeiten und Selbstvertrauen und Optimismus zu gewinnen.
- individuelle Symptome je nach Stadium der Erkrankung und Nebenwirkung der Therapie (z. B. Hautpflege bei Bestrahlung, antiemetische Therapie etc.)
- Appetitmangel: Eine Gewichtsabnahme (in Richtung einer frühzeitigen Tumorkachexie) wirkt abwehrschwächend und sollte durch eine ausreichende Ernährung vermieden werden (siehe hier).
Bedeutung realistischen oder positiven Denkens: Der Glaube, dass positives Denken dazu verhilft, mit Krebs fertig zu werden, ist offenbar nicht ausschließlich richtig. Auch realistisches Denken hat einen günstigen Einfluss. Das wird in Studien an Patientinnen mit Mammakarzinom untersucht 29. Ganz allgemein fördert eine übermäßig optimistische Einstellung unberechtigte diagnostische und therapeutische Aufwände und erhöhte Gesundheitskosten, wahrscheinlich auch psychische Zusammenbrüche bei Enttäuschung, so dass es nicht immer klar ist, in welchem Ausmaß positives Denken gefördert werden sollte. Wichtig ist in jedem Fall die Abwehr negativen Denkens und die Behandlung einer Depression 30.
Behandlung des wiederkehrenden Karzinoms
Capivasertib: Der fortgeschrittene ausbehandelte Brustkrebs (HR+, HER -) hat mit Capivasertib, einem AKT-Hemmer eine neue Therapieoption. Wenn er zu Fulvestrant (ein Antiöstrogen) zugesetzt wird, verlängerte sich laut einer Studie die Überlebenszeit ohne Krankheitsfortschritt von durchschnittlich 3,6 Monate auf 7,2 Monate. Der PI3K/AKT/mTOR-Signalweg ist ein intrazellulärer Signalweg, der den Zellzyklus reguliert, bei einigen Tumoren überaktiv ist und durch AKT-Inhibitoren, wie Capivasertib, gehemmt wird. Fulvestrant senkt die Zahl der zellulären Östrogenrezeptoren (SERD, selektiver Östrogenrezeptor-Degrader). Beide Medikamente wirken beim Brustkrebs synergistisch. 13
Für den (HR+ und HER2–) metastasierten Brustkrebs wurde eine weitere Therapieoption in einer Studie getestet. Sacituzumab Govitecan hat die mittlere Überlebenszeit auf im Mittel 14,4 Monate vs. 11,2 Monate unter Chemotherapie verlängert. Die Wirksubstanz ist ein Antikörper-Wirkstoff-Konjugat aus einem humanisierten monoklonalen Antikörper gegen das Trophoblasten-Zelloberflächen-Antigen 2 (Trop-2) und dem aktiven Metaboliten des Topoisomerase-Hemmers Irinotecan. 31
Inavolisib plus Palbociclib-Fulvestrant: Wenn die bisherige Standardtherapie versagt, zeigt eine neue Medikamenten-Kombination bei Patientinnen mit besonderen Voraussetzungen (PIK3CA-Mutation, HER2 neg., Hormonrezeptor pos.) in einer Zulassungsstudie sehr gute Ergebnisse: Die Therapiegruppe Inavolisib plus Palbociclib-Fulvestrant erreichte durchschnittlich ein Überleben ohne Krankheitsfortschritt von 15,0 Monaten (vs. 7,3 Monaten unter Palbociclib-Fulvestrant allein) bei einem Ansprechen bei 58,4 % (vs. 25%). Als zusätzliche Nebenwirkung, neben Blutbildveränderungen (Neutropenie, in beiden Gruppen um 80%), traten vor allem Hyperglykämie (Überzuckerung, 5,6 vs. 0%), Schleimhautentzündungen (5,6 vs. 0%) und Durchfall (3,7 vs. 0%) auf. 32
Inavolisib (ein PIK3CA-Hemmer) zusätzlich zu Palbociclib–Fulvestrant 33: Brustkrebs in fortgeschrittenem Stadium, der trotz individueller Behandlung fortschreitet, erhält eine Therapieoption. Die Voraussetzungen sind HER2-negativ, Hormonrezeptor positiv und PIK3CA mutiert. In einer Zulassungsstudie errechnete sich das mittlere Überleben nach Inavolisib zusätzlich zu Palbociclib–Fulvestrant zu 34 Monate (vs. 27 Monate unter Palbociclib–Fulvestrant ohne Inavolisib). Die Ansprechrate war mit 62,7% (vs. 28,0%) ebenfalls deutlich höher. Allerdings war auch die Nebenwirkungsrate (Hyperglykämie, Magendarm-Symptome, trockene Augen) höher.
→ Auf facebook informieren wir Sie über Neues und Interessantes.
→ Verwalten Sie Ihre Laborwerte mit der Labor-App Blutwerte PRO – mit Lexikonfunktion.
Verweise
- Brustkrebs in Bildern
- Mammographie – Screening auf Brustkrebs
- Männlicher Brustkrebs
- Tumormarker für Brustkrebs CA 15-3
- Darmkrebs – der häufigste Krebs beider Geschlechter
- Tumorsuche
Weiteres
- Wildiers H, Ann Oncol. 2010 Aug 13. [Epub ahead of print][↩][↩]
- Signal Transduct Target Ther. 2025 May 26;10(1):169. doi: 10.1038/s41392-025-02254-3[↩]
- J Natl Cancer Inst 1996;88:1529–42[↩]
- J Natl Cancer Inst 2001;93:684–90[↩]
- Semin Cancer Biol. 2021 Jul;72:136-145. doi: 10.1016/j.semcancer.2020.06.005[↩]
- N Engl J Med. 2006 Dec 28;355(26):2733-43[↩]
- Breast Cancer Res Treat. 2008 Dec;112(3):533-43[↩]
- Clin Ther. 2009;31 Pt 2:2332-48[↩]
- N Engl J Med 2022; 386:942-950 DOI: 10.1056/NEJMoa2114663[↩]
- Lancet Oncol. 2013 May;14(6):461-71[↩]
- BMC Cancer. 2016 Jul 16;16:487. doi: 10.1186/s12885-016-2490-z[↩]
- Oncotarget. 2016 Jun 21. doi: 10.18632/oncotarget.10195. [↩]
- N Engl J Med 2023; 388:2058-2070 DOI: 10.1056/NEJMoa2214131[↩][↩]
- Cancer Cell. 2017 Jun 12; 31(6):820-832.e3.[↩]
- Proc Natl Acad Sci U S A. 2019 Apr 23;116(17):8380-8389. doi: 10.1073/pnas.1821093116.[↩]
- Cell Death Dis. 2013 Aug 15;4:e767. doi: 10.1038/cddis.2013.283.[↩]
- Cancer Discov. 2016 Apr; 6(4): 353–367.[↩]
- Breast Cancer (Dove Med Press). 2014 Aug 4;6:123-33[↩]
- N Engl J Med 2016; 375:1925-1936[↩]
- N Engl J Med 2019; 381:307-316 DOI: 10.1056/NEJMoa1903765[↩]
- Clin Cancer Res. 2022 Mar 1;28(5):851-859. doi: 10.1158/1078-0432.CCR-21-3032[↩]
- N Engl J Med. 2022 Mar 10;386(10):942-950. DOI: 10.1056/NEJMoa2114663[↩]
- N Engl J Med. 2025 Nov 13;393(19):1912-1925. doi: 10.1056/NEJMoa2511734[↩]
- Nature. 2019 Mar 13. doi: 10.1038/s41586-019-1019-4.[↩]
- Eur J Surg Oncol. 2018 Nov;44(11):1703-1707. DOI: 10.1016/j.ejso.2018.06.026[↩]
- Clin Breast Cancer. 2019 Dec;19(6):e669-e682. DOI: 10.1016/j.clbc.2019.05.011[↩]
- N Engl J Med. 2025 Mar 13;392(11):1051-1064. doi: 10.1056/NEJMoa2412063[↩]
- Breast Care (Basel). 2022 Aug;17(4):421-429. DOI: 10.1159/000524789.[↩]
- J Health Psychol. 2016 Dec 6. pii: 1359105316681062. [Epub ahead of print][↩]
- Curr Opin Psychiatry. 2015 Mar;28(2):194-8[↩]
- Lancet. 2023 Oct 21;402(10411):1423-1433. doi: 10.1016/S0140-6736(23)01245-X[↩]
- N Engl J Med. 2024 Oct 31;391(17):1584-1596. doi: 10.1056/NEJMoa2404625[↩]
- N Engl J Med. 2025 Jul 10;393(2):151-161. doi: 10.1056/NEJMoa2501796 [↩]