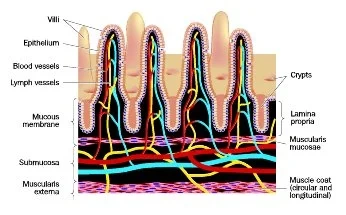
Allgemeines
Ursache und Entstehung des Reizdarmsyndroms (engl.: irritable bowel syndrome, IBS) sind weitgehend geklärt. Es wird davon ausgegangen, dass eine genetische Veranlagung vorliegt und ein Auslöser (z. B. ein Darminfekt, s. u.) zur Symptomatik führt. Ein zentraler Mechanismus ist eine krankhaft veränderte Reaktionsbereitschaft der Schleimhaut auf das Mikrobiom des Darms. Sie führt zu einer Undichtigkeit der Schleimhaut mit Auswirkungen auf die Empfindlichkeit der Darmnerven und der Darmmuskulatur und auf das Darm-assoziierte Immunsystems. Die beobachtbaren Veränderungen und Folgen erstrecken sich nicht nur auf den Darm selbst, sondern auch auf das Gehirn und die dort generierte Schmerzempfindlichkeit.
Einflussfaktoren
Erkenntnisse auf den Gebieten der Genetik, der Mikrobiota des Darms und der Darm-Hirn-Achse sowie der Gallensäuren nehmen eine Schlüsselstellung im Verständnis der Entstehung und Unterhaltung der Reizdarmsyndroms ein 1.
Genetik
Es gibt Hinweise auf eine genetische Prädisposition; eine familiäre Häufung ist bekannt. 2 Es gibt inzwischen mehrere Gen-Kandidaten; darunter ist eine Assoziation mit einem Polymorphismus des Serotonin-Transporter-Gens festgestellt worden 3. In einer genomweiten Studie wurde ein Genort (9q31.2 auf Chromosom 9) gefunden, der speziell bei Frauen mit dem Reizdarmsyndrom assoziiert ist. 4
Darm und Darmbakterien
Barrierefunktion der Darmschleimhaut: Ein Defekt der Schleimhautbarriere wird als einer der wesentlichen Auslöser für das Reizdarmsyndrom angesehen. Bestimmte Bakterien können die Barrierefunktion offenbar besonders schädigen, andere, wie Lactobacillus rhamnosus GG, wiederherstellen. 5
Darmflora: Die Zusammensetzung der Bakterienstämme im Darm (Darmmikrobiom) von Patienten mit Reizdarm ist gegenüber Normalpersonen verändert: Bestimmte Populationen nützlicher Arten, wie Lactobacillus und Bifidobacterium, nehmen bei IBS ab, und Populationen potenziell schädlicher Bakterien, wie Firmicutes und Proteobacteria, nehmen zu 6.
Ein „gesundes Mikrobiom“ ist gekennzeichnet durch eine hohe Diversität (Vielfalt) und eine ausreichende Menge an Butyrat-produzierenden Bakterien. Es zeigt eine Widerstandsfähigkeit gegen Störung und die Fähigkeit, nach einer Störung zu seiner ursprünglichen Zusammensetzung zurückzukehren. Beim Reizdarmsyndrom ist die Diversität des Mikrobioms eingeschränkt und die Balance zwischen Mikrobiom und Wirt gestört. 7 IBS wird daher auch als eine Krankheit des Darmmikrobioms angesehen. 8
Der erhöhte Verzehr westlicher Kost mit glutenhaltigen oder fettreichen Lebensmittel beeinflusst das Darm-Mikrobiom und die IBS-Symptomatik. Bei koreanischen Erwachsenen verursachte er mehr Symptome als hohe FODMAPs und Milchprodukte (FODMAPs: fermentierbare Oligosaccharide, Disaccharide, Monosaccharide und Polyole) 9. Gluten scheint dabei aber keine Rolle zu spielen, sondern eher Weizen und Gerste 10. Weitere Belege deuten darauf hin, dass eine Low-FODMAP-Diät zwar die IBS-Symptome deutlich reduzieren kann, aber auch zu einer Verringerung nützlicher mikrobieller Populationen führen kann.
Eine Stuhltransplantation (fekale Mikrobiota-Transplantation, FTM, mit „gesundem Mikrobiom“) sowie die Zufuhr geeigneter Bakterienspezies (abgepackt in Kapseln) werden als eine potenzielle Therapieoption betrachtet. 11 Eine zusammenfassende Studienauswertung besagt, dass Probiotika und FMT bei der Behandlung von IBS wirksam sind, wobei Bifidobacterium und Lactobacillus die dominanten Stämme sind 12.
Rolle von Gallensäuren
Die in der Leber gebildeten primären Gallensäuren werden durch einige Bakterien (vor allem bestimmte Clostridien) in sekundäre Gallensäuren umgewandelt. Diese wirken je nach ihrer Struktur günstig oder ungünstig auf die Darmwand. Sie beeinflussen sowohl die Motilität, als auch die Schleimsekretion und zudem die Dichtigkeit des Epithels.
Bei Reizdarm mit überwiegendem Durchfall wurde ein signifikanter Anstieg der primären Gallensäuren im Stuhl und ein Rückgang des sekundären Gallensäuren gefunden. Entsprechend wurden solche Bakterienstämme im Darm vermindert gefunden, die primäre Gallensäure zu sekundären umwandeln. 13
Gallensäuren im Stuhl können als diagnostische Marker dienen. Bei IBS-D waren Chenodesoxycholsäure (CDCA), Cholsäure (CA) und primäre Gallensäuren signifikant höher als bei Gesunden oder IBS-C. Dagegen war Desoxycholsäure (DCA) bei IBS-C signifikant niedriger als bei IBS-D. 14 Aufgrund der Gallensäurezusammensetzung des Stuhls kann ein jeweils individuelles Therapiekonzept aufgestellt werden. 15
Bakterien und Antibiotika
Als Reizdarm-Auslöser kommen Bakterien und auch Antibiotika in Betracht: 16 17
Eine vorangegangene Antibiotikatherapie stellt ein erhöhtes Risiko für die Entwicklung eines Reizdamsyndroms dar. Es ist anzunehmen, dass sie zu einer Alteration der Kolonflora (Dysbiose) führt.
Eine akute Gastroenteritis (infektiöse Durchfallkrankheit) bildet ein erhöhtes Risiko. 18 19
Eine Infektion mit Mycobacterium avium subsp. paratuberculosis (oft durch Verzehr von handgemachtem Käse erworben) wird als mögliche Ursache eines Reizdarmsyndroms (wie auch des Morbus Crohn) diskutiert. 20
Antibiotika können die Zusammensetzung des Darmmikrobioms verschieben, sodass Keime aufkommen, die den Mix der Gallensäuren im Darm ungünstig beeinflussen. Die Veränderung der Gallensäurezusammensetzung wirkt sich auch auf die Darm-Hirn-Achse aus (s. o. und siehe hier).
Weitere Einflussfaktoren
Die Psyche scheint über diesen Weg vielfachen Einfluss auf Auslösung und Verlauf des Reizdarmsyndroms zu nehmen. Diskutiert wird, dass im Einzelfall traumatische Ereignisse und familiäre Belastungssituationen in der Kindheit, neurotische Entwicklung und Medikamenten- oder Drogenabhängigkeit eine Rolle spielen können. 21
Emotionaler Stress: Stress und neurotische Fehlhaltung sind als Reizdarm-Auslöser möglich; psychologische Faktoren tragen offenbar zu einer veränderten Schmerzwahrnehmung bei 22, liegen aber nicht bei jedem Patienten vor. Heute wird die wechselseitige Beeinflussung von Gehirn und Darm (brain-gut axis) als gegeben angesehen.
Ursache kann sein, dass bei emotionalem Stress in bestimmten Regionen des Gehirns durch Fehlregulation ein Tryptophan- und Serotonin-Mangel (Serotonin: 5-Hydroxytryptamin; 5-HT) eintritt, der sich auch in einem erhöhten Schmerzempfinden und vermehrter Darmmotilität inklusive gesteigertem Stuhldrang auswirkt. 23 24
Eine geringe Tryptophan-Aufnahme verringerte (in 5 Studien) die Beschwerden und verbesserte das psychische Wohlbefinden bei IBS-Patienten 25.
Rolle von Serotonin und Tryptophan: Darmmikrobiota beeinflussen über Mastzellen (sie entlassen Prostaglandin E2, PGE2) die Expression des mukosalen Serotonin-Wiederaufnahmetransporters beim Reizdarmsyndrom. Bei Patienten mit Reizdarmsyndrom veranlasst fäkales Lipopolisaccharid zusammen mit Trypsin die Mastzellen der Schleimhaut, Prostaglandin E2 (PGE2) freizusetzen. Dadurch wird der Schleimhaut-SERT (Serotonin-Wiederaufnahmetransporter) herunterreguliert, was zu einem erhöhten 5-Hydroxytryptamin (5-HT) in der Schleimhaut führt. 26 Interessant in diesem Zusammenhang ist es, dass ein genetischer Polymorphismus des Serotonin-Transportergens mit einem Reizdarmsyndrom assoziiert ist (s. o.).
Tryptophan (TRP) ist eine Vorstufe für Serotonin. Serotonin ist ein Neurotransmitter, der eine Rolle bei der Regulierung der Magen-Darm-Motilität und -Sekretion spielt. Der TRP-Stoffwechsel beeinflusst die IBS-Symptomatik, und eine Verminderung der TRP-Aufnahme stellt eine Möglichkeit dar, über eine Beeinflussung des Serotoninspiegels die IBS-Symptomatik zu beeinflussen 27.
Veränderte rektale Empfindlichkeit: Sie spielt bei vorherrschender Verstopfung (Obstipation) eine Rolle.
Hormone: Eine prämenstruelle Verschlechterung deutet auf eine hormonelle Beeinflussung.
Laktoseintoleranz: Eine Laktoseintoleranz stellt keine Reizdarm-Ursache dar; sie sollte ausgeschlossen sein. Allerdings kann sie zu einer erheblichen Verschlechterung der Symptomatik bei Reizdarm führen.
Interkurrenter Darminfekt: Jeder Darminfekt und jede Darmentzündung geht mit einer Beeinflussung des Darmmikrobioms einher und kann bei einer entsprechenden Veranlagung ein Reizdarmsyndrom auslösen. So kann eine Salmonellenenteritis im Kindesalter ein Risikofaktor für das Reizdarmsyndrom im Erwachsenenalter darstellen. 28 Eine Untersuchung zeigt, dass das Risiko eines Reizdarmsyndroms 4,2-fach erhöht ist, wenn innerhalb der letzten 12 Monate eine bakterielle Enteritis durchgemacht wurde. Ein Darmbefall mit Protozoen oder Parasiten führte besonders oft zu einem Reizdarmsyndrom. 29
Interferon-Gamma: Die IFN-γ-mRNA-Spiegel in der Darmschleimhaut von PI-IBS-Patienten (PI: post infectionem) waren in einer Untersuchung signifikant höher als in der von Nicht-PI-IBSPatienten. 30 Das IFN-γ-Gen und die IFN-γ-Proteinexpression sind in der Dickdarmschleimhaut von Patienten mit Reizdarmsyndrom erhöht. IFN-γ reguliert die SERT-Genexpression (Serotonin-Wiederaufnahmetransporter) in vitro herunter und spielt daher wahrscheinlich eine Rolle beim veränderten Serotoninstoffwechsel in der Schleimhaut von Reizdarmpatienten. 31
Therapeutische Konsequenzen
IBS-Beschwerden lassen sich in vielen Fällen über Probiotika und eine Änderung der Ernährung lindern. Eine zusammenfassende Auswertung von 6528 Artikeln, in denen 54 Probiotika, 7 Präbiotika/Synbiotika und 6 FMT getestet wurden, besagt Folgendes: Probiotika mit Bifidobacterium- und Lactobacillus-Stämmen zeigten eine Verbesserung der IBS-Symptome. Präbiotika und Synbiotika zeigten dagegen keine signifikante Verbesserung. 12
Eine Analyse von 52 randomisierten, doppelblinden und Placebo-kontrollierten Studien ergab, dass die Wirkung verschiedener Probiotika variiert. Die minimale wirksame Dosis von Probiotika liegt bei 10^9 c.f.u./Tag. Mit einer geeigneten Probiotika-Formel tritt die therapeutische Wirkung durchschnittlich nach 4 Wochen ein. 32
Eine fekale Mikrobiota-Transplantation (FTM) durch EInlaäufe hat in einer Übersicht von sechs FMT-Studien ergeben, dass bei 28 der 48 (58 %) behandelten Patienten die Transplantation einen günstigen Effekt auf die Symptomatik hatte. Besonders effektiv waren Stuhltransplantate von Bifidobakterium-reichen Spendern 33.
→ Auf facebook informieren wir Sie über Neues und Interessantes!
→ Verwalten Sie Ihre Laborwerte mit der Labor-App Blutwerte PRO – mit Lexikonfunktion.
Verweise
- Reizdarm
- Die Verdauung und ihre Regulation: Basics
- Funktionelle Dyspepsie
- Blähungen
- Laktoseintoleranz
- Nahrungsmittelunverträglichkeit
- Nahrungsmittelallergie
- Magendarmkanal
Weiteres
- World J Gastroenterol. 2023 Jul 14;29(26):4120-4135.[↩]
- Am J Gastroenterol. 1998 Aug; 93(8):1311-7[↩]
- Gut Liver. 2012 Apr;6(2):223-8[↩]
- Gastroenetrology July 2018 Volume 155, Issue 1, Pages 168–179[↩]
- Gut Microbes. 2018 Jul 24:1-18. doi: 10.1080/19490976.2018.1479625[↩]
- Int J Mol Sci. 2024 Nov 19;25(22):12395. doi: 10.3390/ijms252212395.[↩]
- Nat Rev Microbiol. 2017 Oct;15(10):630-638. DOI: 10.1038/nrmicro.2017.58[↩]
- Front Cell Infect Microbiol. 2020 Sep 9;10:468. doi: 10.3389/fcimb.2020.00468[↩]
- Nutrients. 2021 Apr 15;13(4):1308. doi: 10.3390/nu13041308[↩]
- Clin Nutr ESPEN. 2022 Feb;47:45-50. doi: 10.1016/j.clnesp.2021.12.019[↩]
- Scand J Gastroenterol. 2021 Jul;56(7):761-769. DOI: 10.1080/00365521.2021.1915375.[↩]
- Nutrients. 2024 Jul 2;16(13):2114. doi: 10.3390/nu16132114[↩][↩]
- J Neurogastroenterol Motil. 2022 Oct 30;28(4):549-561. DOI: 10.5056/jnm22129[↩]
- Aliment Pharmacol Ther. 2019 Mar;49(6):744-758.[↩]
- Gut. 2023 Mar;72(3):590-599. doi: 10.1136/gutjnl-2022-328515[↩]
- World J Gastroenterol. 2022 Mar 28;28(12):1204-1219. doi: 10.3748/wjg.v28.i12.1204[↩]
- J Neurogastroenterol Motil. 2012 Jul;18(3):258-68[↩]
- BMJ. 1999 Feb 27;318(7183):565-6. doi: 10.1136/bmj.318.7183.565. PMID: 10037630; PMCID: PMC27756.[↩]
- Exp Ther Med. 2020 Oct;20(4):3517-3522. doi: 10.3892/etm.2020.9018. Epub 2020 Jul 16. PMID: 32905134; PMCID: PMC7464999.[↩]
- J Clin Microbiol. 2007 Dec;45(12):3883-90[↩]
- World J Gastroenterol. 2012 Feb 21;18(7):616-26[↩]
- Scand J Gastroenterol. 2007 Apr;42(4):441-6[↩]
- Eur J Gastroenterol Hepatol. 2012 Nov;24(11):1259-65[↩]
- Gut. 2011 Sep;60(9):1196-203.[↩]
- Int J Gen Med. 2024 Sep 16;17:4141-4151. doi: 10.2147/IJGM.S474525. PMID: 39308964[↩]
- Gastroenterology. 2022 Jun;162(7):1962-1974.e6. DOI: 10.1053/j.gastro.2022.02.016[↩]
- Int J Gen Med. 2024 Sep 16;17:4141-4151. doi: 10.2147/IJGM.S474525[↩]
- Gastroenterology. 2014 Jul;147(1):69-77. DOI: 10.1053/j.gastro.2014.03.013[↩]
- Gastroenterology. 2017 Apr;152(5):1042-1054.e1. DOI: 10.1053/j.gastro.2016.12.039.[↩]
- BMC Gastroenterol. 2012 Jul 20;12:91. doi: 10.1186/1471-230X-12-91[↩]
- Am J Physiol Gastrointest Liver Physiol. 2016 Mar 15;310(6):G439-47. doi: 10.1152/ajpgi.00368.2015[↩]
- J Med Microbiol. 2023 Sep;72(9). doi: 10.1099/jmm.0.001758[↩]
- Kaohsiung J Med Sci. 2020 Mar;36(3):160-170. doi: 10.1002/kjm2.12154[↩]