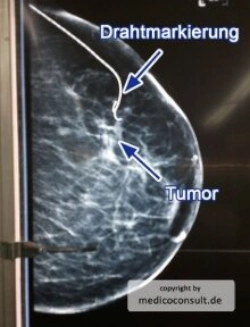
Brustkrebs (Mammakarzinom) ist der häufigste bösartige Tumor der Frau. Bei Männern kommt er sehr selten vor. Rauchen und eine genetische Belastung spielen die Hauptrollen bei der Entstehung. Ein regelmäßiges Brustkrebsscreening kann die Erkrankungshäufigkeit deutlich senken. Die Therapie richtet sich nach dem Typ und hat Fortschritte gemacht. Eine Brustkrebsvorsorge kann Leben retten, wenn ein Tumor noch in einem frühen Stadium erfasst wird und heilend operiert werden kann. Wenn eine Heilung nicht möglich ist, können moderne Therapieoptionen, die sich nach dem Typ des Tumors richten, häufig eine deutliche Lebensverlängerung bewirken.
→ Siehe hier.